(一)实验室用Na2CO3·10H2O配制500ml 0.10mol·L-1的Na2CO3溶液,填空并请回答下列问题:
(1)根据实验要求填表:
| 应量取Na2CO3·10H2O的质量/g |
应选用容量瓶的规格/mL |
除容量瓶外还需要的其它玻璃仪器 |
| |
|
|
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) ;
A.用适量水洗涤烧杯2—3次,洗涤液均注入容量瓶中,振荡。
B.用托盘天平准确称量所需Na2CO3·10H2O的质量,倒入烧杯中,再加入适量水,用玻璃棒慢慢搅动,使其溶解(需要时可加热)。
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作 ;若加蒸馏水时不慎超过了刻度 ;若定容时俯视刻度线 。
(二)喷泉实验是一种常见的自然现象,其产生原因是存在压强差。试根据下图,回答下列问题:
(1)在图A的烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是( )。
A.HCl和H2O B.Cl2和NaOH溶液
C.HCl和汽油 D.CO2和NaOH溶液
(2)在图B的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷 泉的是( )
A.Cu与稀盐酸 B.NaHCO3与NaOH溶液
C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸
(3)在图B的锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质不可能是( )。
A.浓硫酸 B.生石灰 C.硝酸铵 D.烧碱
(4)比较图A和图B两套装置,以产生喷泉的原理来分析,图A是_______上部烧瓶内压强;城市中常见的人造喷泉及火山爆发的原理与上述________(填图A或图B)装置的原理相似。
(填化学式)在空气中:将氯化铁溶液蒸干并灼烧得到的固体物质_______________;碳酸氢钠溶液蒸干并灼烧得到的固体物质_____________;硫酸铝溶液蒸干得到的固体物质___________________;亚硫酸钠溶液蒸干得到的固体物质__________。
某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-、SiO32-中的
若干种组成(不考虑水的电离)。取该溶液进行如下实验:
Ⅰ.取适量溶液,加入过量的盐酸,有气体生成,并得到无色溶液;
Ⅱ.在Ⅰ所得溶液中加入过量的NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;
Ⅲ. 在Ⅱ所得溶液中加入过量的Ba(OH)2溶液,加热,也有气体生成,同时析出白色沉淀乙。
请回答下列问题:
(1)由实验Ⅰ可知原溶液中一定不含有的离子是;
一定含有的离子是。
(2)由实验Ⅱ可知原溶液溶液中还一定含有的离子是;生成甲的离子方程式为。
(3)实验Ⅲ中生成白色沉淀乙的离子方程式为
。
原溶液中还可能存在的离子是;检验该离子的方法是。
已知A、B、C、D、E、F、G为七种短周期的主族元素,原子序数依次增大。已知:A、F的最外层电子数分别等于各自的电子层数,其中A的单质在常温下为气体。C与B、G在元素周期表中处于相邻位置,这三种元素最外层电子数之和为17,质子数之和为31。D与F同周期,且在该周期中D元素的原子半径最大。根据以上信息回答下列问题:
(1)B、C、G的氢化物中稳定性最强的是(填化学式),G的某种氧化物能使溴水褪色,写出该反应的化学方程式。
(2)B、C、D、E、F形成的简单离子半径由大到小的顺序为(用离子符号表示)。
(3)A与B能形成离子化合物A5B,A5B中既含离子键又含共价键,其电子式为,该物质能与水剧烈反应生成两种气体,这两种气体的化学式是。
(4)碳酸盐DACO3溶液与稀硫酸混合,当生成11.2L(标准状况)气体(不考虑气体溶解)时放热6.32kJ,写出该反应的热化学离子方程式。
(5)美国国家科学院(NationalAcademyofSciences)正式发表了题为《行星系统中有机生命的限制》的研究报告。报告称,在温度、压力、物质基础以及能源供给方式都与地球迥异的地外行星上,如果存在生命,它们完全没有必要以地球生命的形式存在。有学者提出,在大气中充满B元素单质并含有丰富的A的化合物的星球上可能存在“B基生命”而不是“碳基生命”。科学家猜想这样的星球上可能会存在着一种组成结构与BA3、B2A4类似的系列化合物如B3A5、B4A6等。该系列化合物的通式为(用元素符号表示)。有B2A 4与另外两种等物质的量的该系列中的化合物组成的混合蒸气,在足量氧气中充分燃烧,只生成B元素的单质和水,且B元素的单质和水的物质的量之比为1:2,则另外两种化合物是(写化学式)。
恒温下,将a mol N2与b mol H2的混合气体通入一定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) 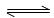 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,n(N2)=13mol,n(NH3)=6mol,
计算a=。
(2)反应达到平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的百分含量(体积分数)为25%。计算:平衡时NH3的物质的量为。
(3)原混合气体与平衡混合气体的总物质的量之比
n(始): n(平)=。
(4)原混合气体中a : b=。
(5)达到平衡时,N2和H2的转化率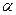 (N2):
(N2): 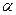 (H2)=。
(H2)=。
(6)平衡混合气体中n(N2): n(H2): n(NH3)=。
A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。
①元素Y在A、B、C、D、E中所呈现的化合价依次递增,其中只有B为单质;
②常温下将气体D通入水中发生反应,生成E和C;
③工业上可以用A与空气为原料,通过催化氧化法得到C。
请回答以下问题:
(1)B的电子式为,A的结构式为,A分子的空间构型是。
(2)写出②中反应的化学方程式
(3)写出③中反应的化学方程式