化合物A、B是中学常见的物质,其阴阳离子只能从下表中选择:
| 阳离子 |
K+、Na+、Fe2+、Ba2+、NH4+、Ca2+ |
| 阴离子 |
OH-、NO3—、I-、HCO3—、AlO2—、HSO4— |
(1)若A、B的水溶液均为无色,且A的水溶液呈强酸性,B的水溶液呈强碱性。混合后产生不溶于稀硝酸的白色沉淀及能使红色石蕊试纸变蓝的气体。
①B的化学式为________________。
②A、B溶液混合加热反应的离子方程式为________。
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色。向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化。则
①A的化学式为____________________。
②经分析上述过程中溶液变黄的原因可能有两种(用离子方程式表示):
i________________________________;ii_______________________________,
③请用一简易方法证明上述溶液变黄的原因:________。
④利用溶液变黄原理,将其设计成原电池,若电子由a流向b(a、b均为石墨电极),则b极的电极反应式为____________________。
Zn+2MnO2+2NH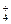 ===Zn2++Mn2O3+2NH3+H2O
===Zn2++Mn2O3+2NH3+H2O
(1)试写出干电池放电时的正、负电极反应式:正极:___________负极:___________
干电池用久了就会变软,其原因是____________________________________________。
(2)正极反应中,前后经历了下列两个反应:
2NH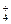 +2e-===2NH3+H2
+2e-===2NH3+H2
2MnO2+H2===Mn2O3+H2O
如果正极反应没有MnO2的参与,干电池将难以持续稳定工作。试说明理由。
(3)在通电10 min的时间内参加反应的MnO2质量约为多少?外电阻消耗的电能是多少?
(4)许多国家对废旧电池进行回收,从保护环境和节约能源解释为什么要回收废旧电池。
阳极反应式:2CO+2CO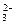
 4CO2+4e-
4CO2+4e-
阴极反应式: ,总电池反应式: 。

(1)当以I="0.21" A的电流电解60 min后,测得铜片A的质量增加了0.25 g,则图装置中的X端应与直流电的__________极相连,它是电解池的__________极。
(2)电解后铜片B的质量__________。(答“增加”“减少”或“不变”)
(3)列式计算实验测得的阿伏加德罗常数NA。(已知电子电量e=1.60×10-19C)
二甲苯苯环上的一溴代物有六种同分异构体,这些一溴代物与生成它的对应二甲苯的熔点分别是:
由上述数据可以推断,熔点为234℃的一溴代二甲苯结构简式是①,熔点为-54℃的二甲苯名称是②。
A、B两种有机化合物,分子式都是C9H11O2N。化合物A是天然蛋白质的水解产物,光谱测定显示:分子结构中不存在甲基(—CH3),化合物A的结构式是_____。化合物B是某分子式为C9H12的芳香烃—硝化后的唯一产物(硝基连在芳环上)。化合物B的结构简式是______。