下列有关化学概念或原理的论述中,正确的是( )
| A.Cl2、SO2、NH3的水溶液都能够导电,因此都属于电解质 |
| B.任何一个氧化还原反应都可以设计为电池,输出电能 |
| C.任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
| D.电解饱和食盐水的过程中,水的电离平衡正向移动 |
尿黑酸症是由酪氨酸在人体内非正常代谢而产生的一种遗传病。其转化过程如下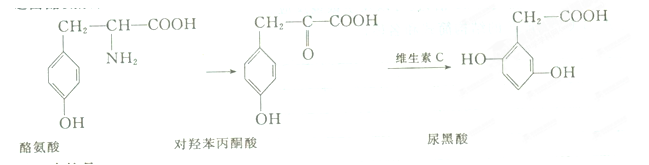
下列说法不正确的是
| A.酪氨酸既能与盐酸反应又能与NaOH溶液反应 |
| B.对羟苯丙酮酸分子中有3种含氧官能团 |
| C.1 mol尿黑酸最多可与含3 mol NaOH的溶液反应 |
| D.可用溴水鉴别对羟苯丙酮酸与尿黑酸 |
下列各组物质的性质排列不正确的是
| A.酸性:H2CO3>H3BO3>Al(OH)3 | B.溶液中结合质子的能力:O2->S2->Cl- |
| C.分散质粒子直径:胶体>浊液>溶液 | D.热稳定性:HF>H2O>NH3 |
下列各组离子在指定溶液中,可能大量共存的是
①溶有足量氨气的无色溶液中:K+,NH4+,Na+,HSO3-,PO43-,MnO4-
②能使pH试纸变深蓝色的溶液中:K+,Na+,AlO2-,NO3-,S2-,SO32-
③水电离的H+浓度c(H+)=10-13mol/L的溶液中:Cl-,CO32-,SO32-,Fe3+,K+
④加入Al能放出H2的溶液中:Na+,NH4+,K+,SO42-,Cl-,Br-
⑤使石蕊变红的溶液中:Fe3+,Na+,K+,NO3-,SO42-,Cl-
⑥pH=1的溶液中:Fe2+,Al3+,K+,Na+,NO3-,I-,Cl-,S2-
⑦含有大量Fe3+的溶液中:K+,NH4+,Na+,SCN-,I-,Br-
⑧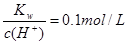 的溶液中:Na+,K+,SO42-,SiO32-,NO3-
的溶液中:Na+,K+,SO42-,SiO32-,NO3-
| A.①③④⑥ | B.①③⑥⑦ | C.②④⑤⑧ | D.②⑤⑦⑧ |
将足量铁粉投入一定浓度的氯化铁和氯化铜的混合溶液中,充分反应后,溶液中剩余固体的质量与加人铁粉的质量相同,则原溶液中氯化铁和氯化铜的浓度之比为 ( )
| A.2:7 | B.3;4 | C.4:7 | D.2:3 |
关于氧化还原反应10AgF+5C12+5H2O==9口+AgClO3+10HF+O2,下列说法不正确的是
| A.每生成1 mol O2,该反应转移电子的物质的量是4NA |
| B.该反应中Cl2既是氧化剂,又是还原剂 |
| C.口中的物质是AgCl |
| D.该反应消耗的水有2/5被氧化 |