常温下,几种难溶电解质的溶度积和弱酸的电离常数如下表所示: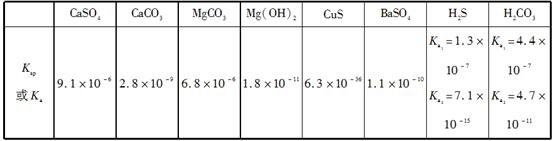
则下列说法不正确的是( )
| A.相同温度、相同浓度的钠盐溶液的pH:Na2S>Na2CO3>NaHS>NaCl>NaHSO4 |
| B.在NaHS溶液中滴加硫酸铜溶液,生成黑色沉淀:HS-+Cu2+=CuS↓+H+ |
| C.除去锅炉中的水垢时,通常先加入足量硫酸钠溶液,将碳酸钙转化成硫酸钙,然后再用酸液处理 |
| D.在Mg(HCO3)2溶液中滴加澄清石灰水发生反应的离子方程式为Mg2++2HCO3—+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O |
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
| 容器 编号 |
起始时各物质的物质的量/mol |
达到平衡时体 系能量的变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出能量:23.15 kJ |
| ② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述错误的是( )
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为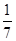
C.容器②中达到平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5 L,则平衡时放出的热量<23.15 kJ
常温下,以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是()
| A.过滤后的溶液中一定没有S2﹣ |
| B.MnS难溶于水,可溶于MnCl2溶液中 |
| C.常温时,CuS、PbS、CdS比MnS更难溶 |
| D.加入MnS后生成CuS的离子方程式是Cu2++S2﹣=CuS↓ |
已知:锂离子电池的总反应为: C+LiCoO2;锂硫电池的总反应为:2Li+S
C+LiCoO2;锂硫电池的总反应为:2Li+S Li2S有关上述两种电池说法正确的是()
Li2S有关上述两种电池说法正确的是()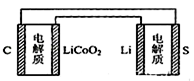
| A.锂离子电池放电时,Li+向负极迁移 |
| B.锂硫电池充电时,锂电极发生还原反应 |
| C.理论上两种电池的比能量相同 |
| D.右图中表示用锂离子电池给锂硫电池充电 |
下列说法不正确的是()
| A.0.2 mol•L﹣1的NaHCO3溶液中:c(Na+)>c(HCO3﹣)>c(OH﹣)>c(H+)>c(CO32﹣) |
| B.将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,盐酸需加的水量多 |
| C.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+)=c(Cl﹣) |
| D.pH=1的NaHSO4溶液:c(H+)= c(SO42﹣)十c(OH﹣) |
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是()
| A.c(OH﹣)>c(H ClO)>c(H2CO3)>c(H+) |
| B.c(OH﹣)>c(HCO3﹣)>c(ClO﹣)>c(H+) |
| C.c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3) |
| D.c(Na+)+c(H+)=c(HCO3﹣)+c(ClO﹣)+c(OH﹣) |