LiAlH4是重要的储氢材料,其组成类似于Na3AlF6。常见的供氢原理如下面两个方程式所示:
①2LiAlH4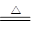 2LiH+2Al+3H2↑
2LiH+2Al+3H2↑
②LiAlH4+2H2O=LiAlO2+4H2↑
下列说法正确的是( )
| A.LiAlH4是共价化合物,LiH是离子化合物 |
| B.生成等质量的氢气,反应①、②转移电子数之比为43 |
| C.氢化锂也是一种储氢材料,供氢原理为LiH+H2O=LiOH+H2↑ |
| D.若反应①中生成3.36 L氢气,则一定有2.7 g铝生成 |
据ETH天文研究所报告,组成太阳的气体中存在20Ne和22Ne,下列关于20Ne和22Ne的说法正确的是
| A.20Ne和22Ne的中子数相同 | B.22Ne的质子数为12 |
| C.20Ne和22Ne的质量数相同 | D.20Ne和22Ne互为同位素 |
当光束通过豆浆时,可观察到丁达尔效应,表明豆浆是
| A.胶体 | B.溶液 | C.悬浊液 | D.乳浊液 |
下列关于氯水的叙述,正确的是
| A.新制的氯水中只含有Cl2和H2O分子 |
| B.新制的氯水可使蓝色的石蕊试纸先变红后褪色 |
| C.光照新制的氯水有气体逸出,该气体是氯气 |
| D.新制的氯水密封放置一段时间溶液的酸性将减弱 |
能证明SO2具有漂白性的是
| A.酸性KMnO4溶液中通入SO2气体后溶液褪色 |
| B.滴入酚酞的NaOH溶液中通入SO2气体红色消失 |
| C.品红溶液中通入SO2气体红色消失 |
| D.溴水中通入SO2气体后溶液褪色 |
下列离子方程式中,书写正确的是
| A.铁和稀硝酸反应:Fe + 2H+ = H 2↑+ Fe 2+ |
| B.向AlCl3溶液中加入过量的氨水反应:Al3+ + 3NH3·H2O = Al(OH)3↓+3NH4+ |
| C.硫酸铜溶液与氢氧化钡溶液反应Ba2++SO42-=BaSO4↓ |
| D.实验室用大理石和稀盐酸制取CO2:2H+ + CO32- = CO2↑+ H2O |