将1 mol CO和2 mol H2充入一容积为1 L的密闭容器中,分别在250℃、T℃下发生反应:CO(g)+2H2(g) CH3OH(g) ΔH=a kJ/mol,如图所示。下列分析中正确的是( )
CH3OH(g) ΔH=a kJ/mol,如图所示。下列分析中正确的是( )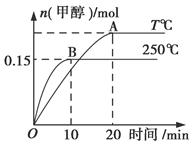
| A.250℃时,0~10 min H2反应速率为0.015 mol/(L·min) |
| B.平衡时CO的转化率:T℃时小于250℃时 |
| C.其他条件不变,若减小容器体积,CO体积分数增大 |
| D.a<0,平衡常数K:T℃时大于250℃ |
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
| 选项 |
实验 |
现象 |
结论 |
| A. |
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 |
有气体生成,溶液呈血红色 |
稀硝酸将Fe氧化为Fe3+ |
| B. |
将铜粉加1.0mol·L-1Fe2(SO4)3溶液中 |
溶液变蓝、有黑色固体出现 |
金属铁比铜活泼 |
| C. |
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 |
熔化后的液态铝滴落下来 |
金属铝的熔点较低 |
| D. |
将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1CuSO4溶液 |
先有白色沉淀生成后变为浅蓝色沉淀 |
Cu(OH)2的溶度积比Mg(OH)2的小 |
甲、乙两溶液中,分别含有大量的Cu2+、K+、H+、Cl-、CO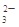 、OH-6种离子中的3种,已知甲溶液呈蓝色,则乙溶液中大量存在的离子是
、OH-6种离子中的3种,已知甲溶液呈蓝色,则乙溶液中大量存在的离子是
A.K+、OH-、CO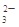 |
| B.Cu2+、H+、Cl- |
| C.K+、H+、Cl- |
D.CO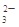 、OH-、Cl- 、OH-、Cl- |
从海带中提取碘的实验过程中,涉及下列操作,其中正确的是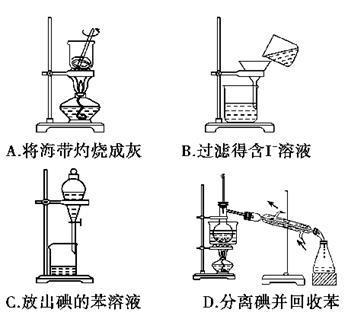
下列各反应中,氧化反应与还原反应在同种元素中进行的是
| A.Cl2+2NaOH===NaCl+NaClO+H2O |
B.2KClO3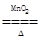 2KCl+3O2↑ 2KCl+3O2↑ |
C.2KMnO4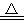 K2MnO4+MnO2+O2↑ K2MnO4+MnO2+O2↑ |
D.2H2O 2H2↑+O2↑ 2H2↑+O2↑ |
下列叙述中正确的是
| A.将SO2通入酸性高锰酸钾溶液中,溶液褪色,不能说明SO2具有漂白性 |
| B.浓盐酸和浓硫酸暴露在空气中浓度都会降低,其原因相同 |
| C.向某无色溶液中滴加氯化钡溶液,产生白色沉淀,再加入稀盐酸后该沉淀不溶解,说明原溶液中一定含有SO42- |
| D.土壤中的闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性 |