在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO2为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO2为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
| A.在该条件下,反应前后的压强之比为65.3 |
| B.若反应开始时容器体积为2 L,则有v(SO3)=0.35 mol/(L·min) |
| C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol |
| D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ |
下列物质之间的反应,一定不能生成盐的是
| A.酸性氧化物与碱反应 | B.碱性氧化物与酸反应 |
| C.单质与化合物的置换反应 | D.金属与氧气化合 |
在标准状况下,将V L A气体(摩尔质量为M g·mol-1)溶于0.1 L水中,所得溶液的密度为ρ g·cm-3,则此溶液中溶质的物质的量浓度(mol·L-1)为
A. |
B.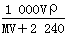 |
C. |
D.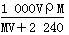 |
下列说法正确的是
| A.某溶液中加入BaCl2溶液,产生不溶于稀盐酸的白色沉淀,则该溶液一定含有SO42﹣ |
| B.FeCl3稀溶液与Fe(OH)3胶体本质区别是分散质粒子的大小 |
| C.Fe(OH)3胶体可以产生电泳现象,由此可知Fe(OH)3胶体带电 |
| D.用溶解、过滤的方法分离KNO3和NaCl固体的混合物 |
津冀地区遭遇三轮雾霾袭击,非常简洁的描述灰霾天气,就是“细粒子气溶胶离子在高湿度条件下引发的低能见度事件”。气溶胶是胶体的一种,关于气溶胶,下列说法不正确的是
| A.气溶胶的分散剂是气体 |
| B.根据分散质和分散剂的状态,可以将胶体分为9种 |
| C.气溶胶分散质粒子直径在1nm-100nm |
| D.胶体不能透过滤纸 |
将下列各组物质按单质、氧化物、酸、碱、盐分类顺序排列,其中正确的是
| A.液态氧、干冰、硫酸、烧碱、氯化钠 |
| B.碘酒、冰、盐酸、烧碱、食盐 |
| C.氢气、二氧化硫、硝酸、纯碱、硝酸钾 |
| D.铜、硫酸钠、醋酸、石灰水、氯化铜 |