如图所示装置中,试管内的FeI2溶液中滴有KSCN溶液,实验中控制通入Cl2的速度,试管内先观察到紫色,后观察到红色。下列说法正确的是( )
| A.若Cl2中含较多HCl,实验过程中会产生倒吸现象 |
| B.通入足量Cl2后,振荡试管,下层变紫色,上层变红色 |
| C.该实验可验证氧化性:Cl2>I2>Fe3+ |
| D.试管内反应的离子方程式可表示为Fe2++2I-+Cl2=I2+Fe3++2Cl- |
德国科学家日前利用卫星数据和一种先进的仪器,绘制了一幅地球上空二氧化氮的分布
图。从科学家绘制的二氧化氮分布图看,欧洲和北美洲的一些大城市上空二氧化氮密度很高。其原因是这些地区的()
| A.硝酸工业发达 | B.雷雨天气较多 |
| C.机动车辆过多 | D.燃料以煤为主 |
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。
某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是()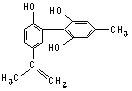
| A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 |
| B.滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构 中存在碳碳双键 |
| C.1 mol该物质分别与浓溴水和H2反应时最多消耗 Br2和H2分别为4 mol、7 mol |
| D.该分子中的所有碳原子不可能共平面 |
以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过加入过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净MnCl2。根据上述实验事实,可推知MnS具有的相关性质是()
| A.具有吸附性 | B.溶解度大于CuS、PbS、CdS |
| C.溶解度小于CuS、PbS、CdS | D.溶解度与CuS、PbS、CdS等相同 |
气态中性原子失去一个电子转化为气态正离子所需要的最低能量叫做第一电离能(I1),气态正离子继续失去电子所需最低能量依次称为第二电离能(I2)、第三电离能(I3)……下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据。
| 元素 |
I1/eV |
I2/eV |
I3/eV |
| 甲 |
5.7 |
47.4 |
71.8 |
| 乙 |
7.7 |
15.1 |
80.3 |
| 丙 |
13.0 |
23.9 |
40.0 |
| 丁 |
15.7 |
27.6 |
40.7 |
下列说法正确的是()
| A.甲的金属性比乙弱 | B.乙的化合价为+1价 |
| C.丙可能为非金属元素 | D.丁一定是金属元素 |
普遍认为环境污染已经成为当前中国发展中的一个重大问题。在一些生产和生活中产生的某气体在近地面空气中浓度稍大时是一种污染物,而在高空却对人类有保护作用,该气体是()
| A.NO | B.O3 | C.CO2 | D.氟氯烃 |