下列叙述正确的是( )
| A.Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 |
| B.漂白粉和明矾都常用于自来水的处理,二者的作用原理不相同 |
| C.将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀 |
| D.过量的铜与浓硝酸反应,生成的气体只有NO2 |
物质的用途与性质密切相关.下列用途主要是利用其物理性质的是



| A.石墨制铅笔芯 | B.氧气用于金属切割 | C.食品充氮防腐 | D.熟石灰改良酸性土壤 |
2013年世界环境日的主题确定为:Think.Eat.Save. ——思前、食后、厉行节约。下面做法符合这一主题的是
| A.生活中使用含磷洗衣粉能给水体提供养分,建议大量使用 |
| B.大力开采矿物,保障金属材料的使用 |
| C.采用焚烧的方法处理农作物秸秆和垃圾 |
| D.推广利用太阳能、风能,缓解温室效应 |
已知反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。某温度下,将2 mol SO2和
2SO3(g) ΔH<0。某温度下,将2 mol SO2和
1 mol O2置于10 L体积可变的密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是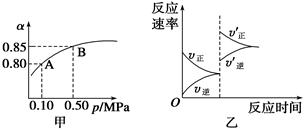

| A.由图甲知,A点SO2的平衡浓度一定为0.04 mol/L |
| B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2 |
| C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
| D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
一密闭体系中发生反应:2SO2(g)+O2(g) 2SO3(g),下图表示该反应的速率(v)在某一时间(t)段内的变化。则下列时间段中,SO3的百分含量最高的是
2SO3(g),下图表示该反应的速率(v)在某一时间(t)段内的变化。则下列时间段中,SO3的百分含量最高的是
| A.t0→t1 | B.t2→t3 | C.t3→t4 | D.t5→t6 |
在0.lmol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH  CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
| A.加入少量NaOH固体,平衡向正向移动, 溶液中c(H+)增大 |
| B.加水,平衡向正向移动, c(CH3COOH)/ c(CH3COO-)增大 |
| C.通入少量 HCl,平衡逆向移动,溶液中c(H+)减少 |
| D.加入少量CH3COONa固体,平衡向逆向移动,溶液导电能力增强 |