现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是________和________。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体。则X为________(填字母)。
A.Br- B.SO42- C.CH3COO- D.HCO3-
(3)将19.2 g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式:________________,若要将Cu完全溶解,至少加入H2SO4的物质的量是________。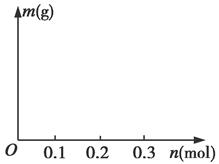
(4)若用惰性电极电解C和D的混合溶液,溶质的物质的量均为0.1 mol,请在坐标系中画出通电后阴极析出固体的质量m与通过电子的物质的量n的关系。(标明纵坐标数值)
(5)E溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为______________________________。
某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是
Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
(1)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是
;
;
第③步中,生成氢氧化铝的离子方程式是
。
(2)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________。(保留一位小数)
(3)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol 碳单质,转移1mol电子,反应的化学方程式是。
X、Y、Z、E、F为五种短周期元素,原子序数依次递增。X+只含有一个质子;Y的最高正化合价、最低负化合价绝对值相等,在同族元素中其氢化物最稳定;Z的原子核内质子数是Y的最外层电子数的2倍;F与Z同主族;E与X同主族。试推断
(1)下列元素分别是:Y__________、Z____________、F__________。(用元素符号表示)
(2)其中原子半径最大的元素是 ,原子半径最小的元素是 .(填元素符号)
(3)X、Z、E形成化合物的电子式为________,所含有的化学键有________;它属于________化合物(填“离子”或“共价”)。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: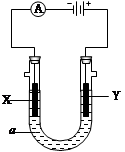
(1)X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为,
在X极附近观察到的现象是。
②Y电极上的电极反应式为,
检验该电极反应产物的方法是。
③总反应的化学方程式。
(2)X、Y都是惰性电极,电解CuSO4溶液,当电路中通过0.4mol 电子时,析出铜的同时在另一个电极可得L O2(标准状况下)
在恒温下,将a mol N2与b mol H2的混合气体通入一个体积为V L固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
(1) 若反应进行到某时刻t时,nt(N2)="13" mol,nt(NH3)="6" mol,计算a的值__________。
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量__________。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同)
n(始)∶n(平)= __________。
(4)原混合气体中a∶b=__________。
(5) 达到平衡时,N2和H2的转化率之比α (N2)∶α (H2)= __________。
(6) 若反应达平衡用时为10分钟,用NH3表示从反应开始到平衡的化学反应速率 __________。
氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电
极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定,请回答: 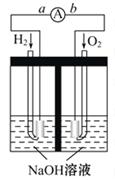
(1)氢氧燃料电池的能量转化形式主要是______,
(2)在导线中电子流动方向为 ____→__(用a、b表示)。
(3)负极反应式为__________________。
(4)电极表面镀铂粉的原因为_________。