过氧化银(Ag2O2)是银锌碱性电池正极的活性物质,可通过下列反应制备:
K2S2O8+2AgNO3+4KOH Ag2O2↓+2KNO3+2K2SO4+2H2O
Ag2O2↓+2KNO3+2K2SO4+2H2O
(1)已知K2S2O8和H2O2含有一个相同的化学键,则该反应________ (填“是”或“不是”)氧化还原反应;已知下列反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+(未配平),反应中氧化剂与还原剂的物质的量之比为________。
(2)制备Ag2O2的反应进行完全后,经过滤、洗涤、干燥,即可得到Ag2O2,检验Ag2O2是否洗涤干净的方法是________。
(3)一种银锌(Ag2O2、Zn)碱性电池的电解质溶液为KOH溶液,电池放电时正极生成Ag,负极只生成一种化合物(只含有Zn、K、H、O),其中Zn元素的质量分数为30%,钾、锌两种元素的质量比为7865,则该电池的总反应方程式为________。
(4)用银锌电池电解尿素[CO(NH2)2]的碱性溶液可制取H2,其装置如图所示(电解池中隔膜仅阻止气体通过,M、N均为惰性电极)。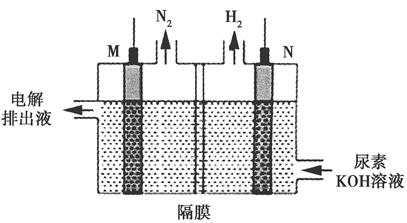
①N极与银锌电池的________(填“Zn”或“Ag2O2”)相连。
②M极的电极反应式为________________________。
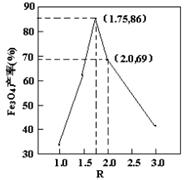
某兴趣小组用废铁泥(主要成分为Fe2O3、FeO和少量Fe)制备磁性Fe3O4纳米材料的流程示意图如下:
|
 ,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
溴及其化合物广泛应用在有机合成、化学分析等领域。
(1)海水提溴过程中溴元素的变化如下: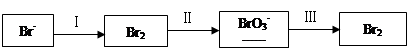
①过程Ⅰ,海水显碱性,调其pH<3.5后,再通入氯气。
ⅰ.通入氯气后,反应的离子方程式是______。
ⅱ.调海水pH可提高Cl2的利用率,用平衡原理解释其原因是______。
②过程Ⅱ,用热空气将溴赶出,再用浓碳酸钠溶液吸收。完成并配平下列方程式。
Br2+ Na2CO3=
Na2CO3= NaBrO3+
NaBrO3+ CO2+
CO2+ ______
______
③过程Ⅲ,用硫酸酸化可得Br2和Na2SO4的混合溶液。
相同条件下,若用盐酸酸化,则所得溴的质量减少,原因是______。
(2)NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6 mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
| 粒子 |
I2 |
Br2 |
IO3- |
| 物质的量/mol |
0.5 |
1.3 |
则原溶液中NaI的物质的量为______mol。
活性炭可处理大气污染物NO。T℃时,在1L密闭容器中加入NO气体和炭粉,发生反应生成两种气体A和B,测得各物质的物质的量如下:
| 活性炭/mol |
NO/mol |
A/mol |
B/mol |
|
| 起始状态 |
2.030 |
0.100 |
0 |
0 |
| 2 min时 |
2.000 |
0.040 |
0.030 |
0.030 |
(1)2 min内,用NO表示该反应的平均速率v(NO)=______mol·L-1·min-1。
(2)该反应的化学方程式是______;T℃时,它的平衡常数K=9/16,则2 min时反应______(填“是”或“不是”)平衡状态;已知升高温度时,K增大,则该反应为______(填“吸热”或“放热”)反应。
(3)为了提高反应速率和NO的转化率,可采取的措施是______。
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。
| Q |
R |
||
| T |
W |
(1)T的原子结构示意图是______。用化学方程式表示工业常用冶炼T单质的原理是______。
(2)与W同主族的某元素,其氢化物分子中含有18个电子,该分子中存在的共 价键的类型是______。
(3)元素的非金属性:Q______W(填“强于”或“弱于”),结合方程式简述其原因是______。
(4)甲是R的氧化物,通常状况下呈红棕色。现有一试管甲,欲使元素R全部转化为其最高价氧化物对应水化物,实验步骤:将盛有甲的试管倒扣在水槽中,______。
以丙烯为原料合成高分子纤维P的路线如下: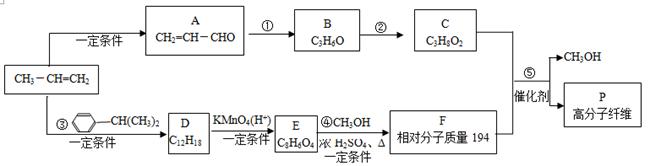
已知:RCOOR'+R"18OH RCO18OR"+R'OH
RCO18OR"+R'OH
(1)①的反应类型是______。
(2)C的核磁共振氢谱显示3个吸收峰,②的化学方程式是______。
(3)③是加成反应,D分子中苯环上的一氯代物只有一种。D的结构简式是______。
(4)④的化学方程式是______。
(5)P的结构简式是______。