人体血液里存在如下平衡:CO2+H2O H2CO3
H2CO3 HCO3-使人体内血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-):c(H2CO3)变化关系如表所示,则下列说法中,正确的是( )
HCO3-使人体内血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-):c(H2CO3)变化关系如表所示,则下列说法中,正确的是( )
| c(HCO3-)c(H2CO3) |
1.0 |
17.8 |
20.0 |
22.4 |
| pH |
6.10 |
7.35 |
7.40 |
7.45 |
A.正常人体血液中,HCO3-的水解程度小于电离程度
B.人体发生酸中毒时,可饮用碳酸饮料缓解
C.pH=7.00的血液中,c(H2CO3)=c(HCO3-)
D.常温下将pH=7.40的血液稀释至pH=7.35,c(H+)·c(OH-)一定不变
在25℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ滴定曲线如图所示。下列说法正确的是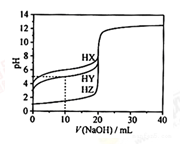
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX |
| B.根据滴定曲线,可得Ka(HY)≈10-6 |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时: c(X-)>c(Y-)>c(OH-)>c(Na+)>c(H+) |
| D.HY与HZ混合,达到平衡时:c(H+)=c(Y-)+c(Z-)+c(OH-) |
在体积恒定的密闭容器中,一定量的SO2与1.00mol O2在催化剂作用下加热到600℃发生反应:2SO2+O2 2SO3ΔH<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同的温度下测得气体压强为反应前的92.125%。下列有关叙述正确的是
2SO3ΔH<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同的温度下测得气体压强为反应前的92.125%。下列有关叙述正确的是
| A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 |
| B.达到平衡时,O2的转化率是31.5% |
| C.达到平衡时,SO2的转化率是31.5% |
| D.降低温度,正反应速率减小程度比逆反应速率减小程度大 |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是: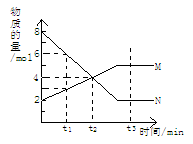
A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
对于可逆反应mA(g)+nB(g) pC(g)+gD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到两种υ~t图象如下图:
pC(g)+gD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到两种υ~t图象如下图: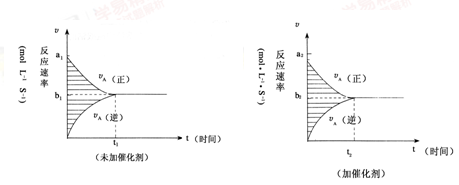
如下关系正确的为 ()
①a1=a2②a1<a2③b1=b2④b1<b2⑤t1>t2⑥t1=t2⑦两图中阴影部分面积相等 ⑧右图阴影部分面积更大
| A.②④⑤⑦ | B.②④⑥⑧ | C.②③⑤⑦ | D.②③⑥⑧ |
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g) + bB(g) xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指()
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指()
A.反应物A的百分含量
B.平衡混合气中物质B的百分含量
C.平衡混合气的密度
D.平衡混合气的平均摩尔质量