Ⅰ.铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是 __。
(2)检验溶液B中是否存在Fe3+的方法是 __。
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是 。
Ⅱ.常温下,某同学将稀盐酸和氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
氨水物质的量浓度/(mol·L-1) |
盐酸物质的量浓度/(mol·L-1) |
混合溶液pH |
| ① |
0.1 |
0.1 |
pH=5 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH>7 |
请回答:
(4)从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)= __mol·L-1;从第②组情况表明,c __(填“>”“<”或“=”)0.2 mol·L-1;从第③组情况分析可知,混合溶液中c(NH4+) __(填“>”“<”或“=”)c(NH3·H2O)。
(5)写出以下四组溶液NH4+浓度由大到小的顺序 __> __> __> __(填选项编号)。
A.0.1 mol·L-1 NH4Cl
B.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 NH3·H2O
C.0.1 mol·L-1 NH3·H2O
D.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 HCl
按要求完成以下化学方程式:
(1)钠与水反应___________
(2)在光照下,次氯酸分解____________
(3)在高温下,铁与水蒸气反应_________
(4)铝与氢氧化钠溶液反应___________
某同学欲配制85mL 0.10 mol/L CuSO4溶液。
(1)若用100 mL容量瓶配制该溶液,应称取胆矾晶体(CuSO4.5H2O)的质量为g。
(2)在配制过程中,该同学已经有天平(带砝码)、药匙、100 mL容量瓶、玻璃棒、胶头滴管,要完成该实验还缺少的仪器是。
(3)下列情况中,能使所配溶液的物质的量浓度偏高的是。
| A.称量固体时将砝码放置在托盘天平左盘 |
| B.胆矾已失去部分结晶水 |
| C.转移溶液时有少量液体流出容量瓶外面 |
| D.定容时俯视刻度线 |
混合物A由KAl(SO4)2、Al2O3和FeO组成,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)D的化学式是,E的化学式是。
(2)写出①、②、④反应的离子方程式:
①;
②;
④。
(3)向溶液C中加入NaOH溶液并长期放置,能观察到的现象是。
(4)某种贫血症患者应补充溶液C中的金属阳离子。含该阳离子的药片外表包有一层特殊的糖衣,这层糖衣的作用之一就是保护该离子不被空气中的氧气氧化。验证长期放置的药片已经失效的方法是:将药片去除糖衣后研碎,取少量研碎的药片放入烧杯中,加适量的蒸馏水,__________(请补充完整),表明该药片已失效。
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
已知:①海水中溴元素(以Br-表示)的浓度0.068g/L;
②Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。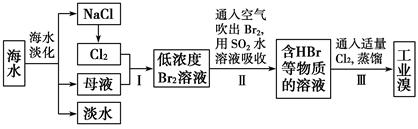
(1)请写出一种海水淡化的方法:_____________。
(2)海水中溴离子的物质的量浓度为_____________。
(3)步骤Ⅰ中已获得低溶度的含Br2溶液,步骤Ⅱ中又将Br2还原为Br-,步骤Ⅲ又得到Br2,其目的为________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为。
(5)工业溴提纯可用蒸馏法,蒸馏时加热方法最好采用,蒸馏装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_________________________________。
下图中,A、B、C、D、E是常见单质,其中B、C、E为金属。G、H、I、F是B、C、D、E分别和A形成的化合物,G物质有磁性。已知:①C与G反应生成B和H且放出大量的热,该反应可用于焊接铁轨;②I是一种常见的温室气体,它和E可以发生反应: ,F中E元素的质量分数为60%。回答问题:
,F中E元素的质量分数为60%。回答问题: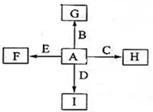
(1)C与G反应的化学方程式为;
(2)单质A的分子式为,化合物I的名称为;
(3)C与NaOH溶液反应的化学方程式为;
(4)过量I与NaOH溶液反应的离子方程式为;