利用化石燃料开采、加工过程产生的H2S废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第三周期,两种元素原子的质子数之和为27,则R的原子结构示意图为________。
②常温下,不能与M单质发生反应的是________(填序号)。
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法
已知:H2S(g) H2(g)+
H2(g)+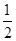 S2(g)
S2(g)
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见下图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。据图计算985℃时H2S按上述反应分解的平衡常数K=________;说明随温度的升高,曲线b向曲线a逼近的原因:____________________________________。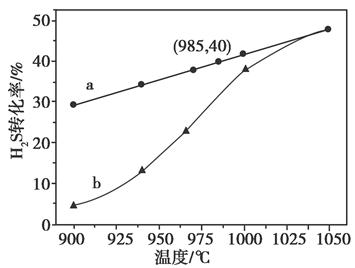
②电化学法
该法制氢过程的示意图如下。反应池中反应物的流向采用气、液逆流方式,其目的是______________________________;
反应池中发生反应的化学方程式为____________________。反应后的溶液进入电解池,电解总反应的离子方程式为_______________。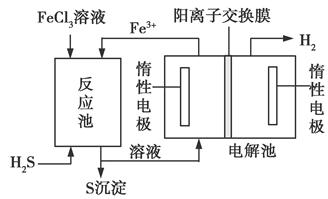
全球气候变暖已经成为全世界人类面临的重大问题。
(1)地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ:H2O(l)=2H+(aq)+1/2O2(g)+2e-△H=+284kJ/mol
Ⅱ:CO2(g)+C5(s)+2H+(aq)=2C3+(s)△H=+396kJ/mol
Ⅲ:12C3+(s)+12e-=C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=-1200kJ/mol
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式
(2)工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇。为探究反应原理,进行如下实验,在体积为1 L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。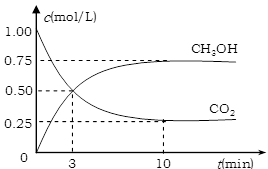
①从反应开始到平衡,氢气的平均反应速率v(H2)=mol/(L·min);
②氢气的转化率=;
③求此温度下该反应的平衡常数K=;
④下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出去 | D.再充入1mol CO2和3mol H2 |
⑤当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2。则c1c2的关系(填>、<、=)。
(3)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标。如图所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。将其插入KOH溶液,从而达到吸收CO2的目的。
①通入氧气一极的电极反应式为;
②随着电池不断放电,电解质溶液的pH(填“增大”、“减小”或“不变”)。
③通常情况下,甲烷燃料电池的能量利用率(填大于、小于或等于)甲烷燃烧的能量利用率。
(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+)0.2mol/LHCl溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)= mol/L。
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度MCl的水解程度。(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH。(填“>7”、“<7”、或“无法确定”)
(4)用0.1032mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
| 实验序号 |
0.1032mol/L HCl溶液体积/mL |
待测NaOH溶液体积/mL |
| 1 |
27.83 |
25.00 |
| 2 |
26.53 |
25.00 |
| 3 |
27.85 |
25.00 |
①待测NaOH溶液的物质的量浓度为mol/L。(保留四位有效数字)
②下列情况可能引起测定结果偏高的是。
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定前,滴定管中的溶液液面最低点在“0”点以下
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂。已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定。
| 化学式 |
AgCl |
AgBr |
AgI |
Ag2S |
Ag2CrO4 |
| 颜色 |
白色 |
浅黄色 |
黄色 |
黑色 |
红色 |
| Ksp |
1.8×10-10 |
5.0×10-13 |
8.3×10-17 |
2.0×10-48 |
1.8×10-10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的 。
A.KBr B.KI C.K2S D.K2CrO4
已知:(A)Cu2+,Fe2+在pH为4~5的条件下不水解而Fe3+却几乎全部水解;(B)双氧水(H2O2)是强氧化剂,在酸性条件下,它的还原产物是H2O。用粗氧化铜(CuO中含少量Fe)制取CuCl2溶液过程如下:
①取50mL的盐酸,加入一定量的粗CuO加热搅拌,充分反应后过滤,溶液的pH是3
②向滤液中加入双氧水,搅拌。
③向②中加入过量纯CuO,微热,搅拌,此时测定溶液的pH为4,过滤。
④把③所得滤液浓缩。
(1)②中发生反应的离子方程式是。
(2)③中过滤后滤渣的成分是。
(3)①③中如何用pH试纸测定溶液的pH值:。
(4)③中pH升高的原因是:。(用离子方程式表示)
(1)依据反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如下图甲所示。
①电极X的材料是;
②外电路中的电子是从电极流向电极(填电极材料名称或符号)。
③在电池放电过程中,盛有饱和KCl琼脂溶胶的盐桥中,向CuSO4溶液一端扩散的离子是(填离子符号)。
(2)①金属腐蚀一般可分为化学腐蚀和电化学腐蚀。炒过菜的铁锅未及时清洗容易发生电化学腐蚀而生锈。请写出铁锅生锈过程的正极反应式:。
②为了减缓某水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案,其中焊接在铁闸门上的固体材料R可以采用(填写字母序号)。
A.铜 B.钠C.锌 D.石墨
③图丙所示方案也可以减缓铁闸门的腐蚀速率,则铁闸门应连接直流电源的极。
(3)蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2 + Fe + 2H2O Fe(OH)2 + Ni(OH)2。
Fe(OH)2 + Ni(OH)2。
①若此蓄电池放电时,该电池某一电极发生还原反应的物质是(填序号)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
②该电池放电时,正极附近溶液的PH(填增大、减小、不变)
③充电时该电池阳极的电极反应式。
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。回答下列有关双氧水的一些问题:
(1)下述反应中,H2O2仅体现氧化性的反应是(填代号)_________。
| A.Na2O2+2HCl ="=" 2NaCl+H2O2 |
| B.Ag2O+H2O2="=" 2Ag+O2↑+H2O |
| C.2H2O2 ="=" 2H2O+O2↑ |
| D.3H2O2+Cr2(SO4)3+10KOH ="=" 2K2CrO4+3K2SO4+8H2O |
(2)保存过氧化氢的试剂瓶上最适合贴上的一个标签是_________(填字母代号)。
(3)某强酸性反应体系中,反应物和生成物共六种物质或离子:O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2↑。
①写出该反应的离子方程式并配平___________________________________________。
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子数目为_________。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+ H2O2+ H2O==A+NH3↑,试指出生成物A的化学式为__________________,并阐明H2O2被称为“绿色氧化剂”的理由是_____________________________________________。