若NA为阿伏加德罗常数,已知某元素的阴离子Rn-的原子核中,中子数为A-x+n,其中A为原子的质量数,则m g Rn-中电子总数为( )
A.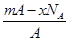 |
B.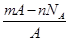 |
C.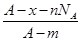 |
D.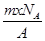 |
在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
①K+、Cl-、NO3-、S2-②K+、Fe3+、I-、SO42-
③Na+、Cl-、NO3-、SO42-④Na+、Ca2+、Cl-、HCO3-⑤K+、Ba2+、Cl-、NO3-
| A.①③ | B.③⑤ | C.③④ | D.②⑤ |
在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可以得到该物质的固体的是()
| A.AlCl3 | B.MgSO4 | C.(NH4)2CO3 | D.NaHCO3 |
下列叙述正确的是()
| A.95℃纯水的pH<7,说明加热可导致水呈酸性 |
| B.pH=3的醋酸溶液,稀释至10倍后pH=4 |
| C.0.2mol/L的盐酸,与等体积水混合后pH=1 |
| D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
0.1mol/LNaHCO3的溶液的pH最接近于()
| A.5.6 | B.7.0 | C.8.4 | D.13.0 |
在一定温度下体积固定的密闭容器中,当下列物理量:①混合气体的压强②气体的总物质的量③混合气体的密度④B的物质的量浓度不再变化时,能表明可逆反应A(s)+2B(g)⇌C(g)+D(g)已达平衡的是()
| A.①② | B.①④ | C.③④ | D.只有④ |