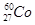 的衰变方程式为
的衰变方程式为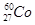 =
=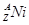 +
+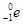 +Ve,其中Ve是反中微子,它的电荷为零,静止质量可以为零。
+Ve,其中Ve是反中微子,它的电荷为零,静止质量可以为零。
(1)下列关于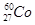 的叙述中,错误的是________(填序号)。
的叙述中,错误的是________(填序号)。
A.质子数是27 B.电子数是27
C.质量数是27 D.中子数是60
(2)在上述衰变方程中,衰变产物Ni的质量数A为______,核电荷数Z为________。
(3)元素的化学性质主要取决于________(填序号)。
A.最外层电子数 B.核内中子数
C.核内质子数 D.质量数不同
(4)不同种元素的本质区别是________(填序号)。
A.质子数不同 B.中子数不同
C.电子数不同 D.质量数不同
下图为中学化学中常见物质的转化关系,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其他为化合物,试推断:
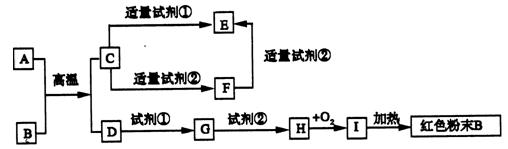
(1)写 出物质的化学式:
出物质的化学式:
(2)写出下列反应的方程式:
C →F的离子方程式:_____________________________________________
→F的离子方程式:_____________________________________________
H→I的化学方程式:______________________________________________
(1) 同期表中位于第8纵行的铁元素属于第________族;
(2) 同期表中最活泼非金属元素位于第________纵行;
(3) 所含元素超过18种的周期是第________、________周期。
I、实验室可利用下列步骤通过“化学放大”来测定极稀的碘化物溶液中I-的浓度:①在中性或弱酸性溶液中,用溴将试样中的I-完全氧化,生成溴化物和碘酸盐,再煮沸以除去过量的Br2;②将所得溶液冷却至室温,加入足量的KI溶液和稀硫酸,充分反应后加入CCl4足量(假设作用完全),再用仪器A将油层分出;③油层用肼(H2N—NH2)的水溶液将CCl4中的I2还原为I-,并进入水溶液中;④水溶液按①法处理;⑤将④所得溶液冷却后加入适量KI溶液并用H2SO4酸化;⑥将⑤所得到溶液取一定量用Na2S2O3标准溶液进行滴定,得出本步骤后溶液中I-的浓度,以此 求出原稀溶液中I-浓度,滴定时的反应为:2Na2S2O3 + I2 = Na2S4O6 + 2NaI。试回答:
求出原稀溶液中I-浓度,滴定时的反应为:2Na2S2O3 + I2 = Na2S4O6 + 2NaI。试回答:
(1)仪器A的名称_____________,如果CCl4用汽油代替,在将油层分出时进行的操作为
______________________________________________________________________________。
(2)如果某试管中有上下两层,均呈无色,采取什么办法判断哪一层是水溶液?
______________________________________________________________________________。
(3)写出离子方程式:
步骤①________________________________________________________;
步骤⑤_______________________________________________。
(4)滴定时,_____________手控制活塞,_____________手摇动锥形瓶。
II、Ag+浓度为0.100 mol·L-1的溶液5 mL,加入等物质的量的某碱金属盐,充分反应后生成卤化物沉淀,经过滤、洗涤后在200 W灯泡下烘干,得到1.297×10-2 g固体。
(5)如果卤化物沉淀为AgX,则其物质的量为_____________mol,根据数据分析上述沉淀是否为AgX沉淀:_ ____________(填“是”或“不是”);若为AgX沉淀,则它的化学式为__________(若不为AgX沉淀,则此空不填)。
____________(填“是”或“不是”);若为AgX沉淀,则它的化学式为__________(若不为AgX沉淀,则此空不填)。
(6)如果卤化物沉淀为碱金属卤化物,其摩尔质量为_____________(计算结果保留整数),根据分析,它的化学式为_____________。
下图表示各物质之间的转化关系,已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
请按要求填空:
(1)写出B的电子式__________________________。
(2)写出生成E的电极反应式: ___________________________________。
反应⑤的现象是_______________________________。
(3)反应①的化学方程式是___________________ _______。
_______。
在实验室中引发反应④的操作是______________________。
(4)反应⑥中若转移1 mol电子,则被还原的X是_____________mol。
已知A只能由某种烯烃与氢气加成而得到,且A分子中含碳82.8%;B、C分别为A的一氯代物。A~I物质有如下图所示的转化关系(反应中生成的无机物已略去)。请通过计算和推断,回答下列问题: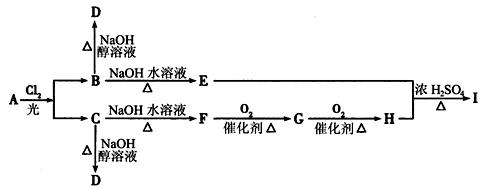
(1) A的分子式是:_____________,A的结构简式为:__________________________。
(2) F的官能团的名称是__________________________。
(3)写出D在一定条件下发生加聚反应的化学方程式:
_________________________________________________________________________。
(4)C→D的化学方程式为:
____________________________________________________________________________,
反应类型:__________________________。
(5)E+H→I的化学方程式为:
______________________________________________________________________________,
反应类型为:__________________________。
(6)G可发生银镜反应,3.6 g G与足量银氨溶液 完全反应,生成Ag的质量为____________g。
完全反应,生成Ag的质量为____________g。