在相同条件下,将相同物质的量的Na、Mg、Al分别加入盛有同浓度、同体积稀盐酸的甲、乙、丙三个烧杯中充分反应,生成气体的体积关系不可能是( )
| A.甲(Na)>乙(Mg)>丙(Al) | B.甲(Na)>乙(Mg)=丙(Al) |
| C.甲(Na)<乙(Mg)<丙(Al) | D.甲(Na)=乙(Mg)=丙(Al) |
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是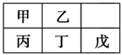
| A.原子半径:丙<丁<戊 | B.金属性:甲>丙 |
| C.氢氧化物碱性:丙>丁>戊 | D.最外层电子数:甲>乙 |
根据元素周期表和元素周期律,下列推断中错误的是
| A.砹是一种有色固体,它的气态氢化物很不稳定 |
| B.F2与水反应比Cl2与水反应剧烈 |
| C.铷的最高价氧化物的水化物一定是强碱 |
| D.由盐酸的酸性比氢硫酸酸性强可推知氯的非金属性强于硫 |
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z新出,X与Y组成原电池时,Y为负极。X、Y、Z 3种金属的活动性顺序为
| A.X>Y>Z | B.X>Z>Y | C.Y>X>Z | D.Y>Z>X |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
X |
Y |
Z |
W |
| 原子半径/pm |
160 |
143 |
70 |
66 |
| 主要化合价 |
+2 |
+3 |
+5、+3、-3 |
-2 |
下列叙述正确的是
A.X、Y元素的金属性X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.四种元素形成的单核离子半径由大到小的顺序为Z3->W2->X2+>Y3+
已知:①钾比水轻;②钾的熔点低;③钾与水反应时要放出热量;④钾与水反应后溶液呈碱性。某学生将一块金属钾投入滴有酚酞试液的水中,该实验能证明四点性质中的
| A.①④ | B.①②④ | C.①③④ | D.①②③④ |