将18 g铜和铁的混合物投入200 mL稀硝酸中,充分反应后得到标准状况下2.24 L NO,剩余9.6 g金属;继续加入200 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是( )
| A.原混合物中铜和铁各0.15 mol |
| B.稀硝酸的物质的量浓度为1 mol/L |
| C.第一次剩余的9.6 g金属为铜和铁 |
| D.再加入上述200 mL稀硝酸,又得到标准状况下2.24 L NO |
在一定温度下,某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g) CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是
CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是
| A.体系的压强不再发生变化 |
| B.v正(CO)=v逆(H2O) |
| C.生成n mol CO的同时生成n mol H2 |
| D.1 mol H—H键断裂的同时断裂2 mol H—O键 |
已知1—18号元素的离子aW3+、bX+、CY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是
| A.四种元素位于同一周期 | B.氢化物的稳定性H2Y>HZ |
| C.离子的氧化性aW3+> bX+ | D.a+3<c-2 |
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是
| A.Y元素最高价氧化物对应的水化物化学式H2YO4 |
| B.原子半径由大到小的顺序为:Z>Y> W |
| C.X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 |
| D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1︰2 |
将一定质量的镁和铝混合物投入200 mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示。则下列说法不正确的是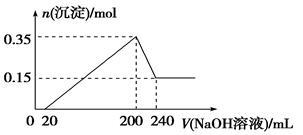
| A.镁和铝的总质量为9 g |
| B.最初20 mL NaOH溶液用于中和过量的稀硫酸 |
| C.氢氧化钠溶液的物质的量浓度为5 mol·L-1 |
| D.生成的氢气在标准状况下的体积为11.2 L |
把6mol铜粉投入含8mol硝酸和2mol硫酸的稀溶液中,则标准状况下放出的气体的物质的量为
| A.2mol | B.3mol | C.4mol | D.5mol |