对于Na+、Mg2+、Al3+三种离子,下列说法不正确的是( )
| A.核外电子层数相同 |
| B.半径大小顺序Na+<Mg2+<Al3+ |
| C.核外电子数相同 |
| D.最外层电子数相同 |
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力
而言,FeS>H2S>CuS,则下列离子方程式错误的是
| A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH- = Mg(OH)2↓+ 2CaCO3↓+ 2H2O |
| B.Cu2+ + H2S = CuS↓+ 2H+ |
| C.FeS + 2H+= Fe2+ + H2S↑ |
| D.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑ |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水” 电池在海水中放电时的有关说法正确的是
| A.正极反应式:Ag+Cl--e-=AgCl |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |
某反应的ΔH=+100 kJ·mol-1,下列有关该反应的叙述正确的是
| A.正反应活化能小于100 kJ·mol-1 |
| B.逆反应活化能一定小于100 kJ·mol-1 |
| C.正反应活化能不小于100 kJ·mol-1 |
| D.正反应活化能比逆反应活化能大100 kJ·mol-1 |
能够使反应Cu+2H2O===Cu(OH)2+H2↑发生的是
| A.用铜片作阴、阳电极,电解氯化铜溶液 |
| B.用铜片作阴、阳电极,电解硫酸钾溶液 |
| C.铜锌合金在潮湿空气中发生电化学腐蚀 |
| D.铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液 |
已知:H+ (aq)+OH- (aq)= H2O(l);△H1 =" -" 57.3 kJ·mol-1,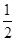 H2SO4(浓)+ NaOH(aq)=
H2SO4(浓)+ NaOH(aq)=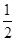 Na2SO4(aq)+ H2O(l);△H2 = m,下列说法正确的是
Na2SO4(aq)+ H2O(l);△H2 = m,下列说法正确的是
| A.上述热化学方程式中的计量数表示分子个数 | B.△H1>△H2 |
| C.△H2 =" -" 57.3 kJ·mol-1 | D.|△H1|>|△H2| |