工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。下列说法中正确的是
| A.该电解槽的阳极反应式是4OH--2e-→2H2O+ O2↑ |
| B.通电开始后,阴极附近溶液pH会减小 |
| C.除去杂质后氢氧化钾溶液从液体出口A导出 |
| D.用氯化钾制备氢氧化钾也可采用这种离子交换膜电解法 |
下列实验对应的结论不正确的是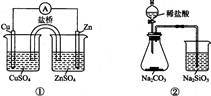
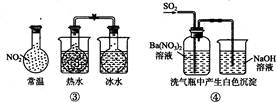
| A.①能组成Zn-Cu原电池 |
| B.②能证明非金属性Cl>C>Si |
C.③能说明2NO2 N2O4△H<0 N2O4△H<0 |
| D.④中自色沉淀为BaSO4 |
下列日常生活中的现象与氧化还原反应无关的是
| A.铜铸塑像上出现铜绿[Cu2(OH)2CO3] |
| B.用石膏点豆腐 |
| C.不良商贩用硫黄熏蒸法制作“白豆芽” |
| D.自来水厂用氯气对水进行消毒 |
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,22.4 L NO与11.2 L O2充分反应后得到的气体分子数为NA |
| B.3.6 g重水中含有的中子数为2NA |
| C.一定条件下,6.4 g铜与过量的硫反应,转移电子数目为0.2NA |
| D.常温下,1 L 1 mol·L-1的CH3COOH溶液中,所含溶质分子数小于NA |
H2SO4和HNO3的浓度分别为4mol/L和2mol/L的混合液,取10mL加入过量的铁粉,若HNO3的还原产物为NO,则生成气体在标况下的总体积为
| A.0.224L | B.0.672L | C.0.112L | D.0.336L |
关于Li、Na、K、Rb、Cs的叙述均正确的一组是
①金属性最强的是铯
②它们的氧化物都只有M2O和M2O2两种形式
③在自然界中均以化合态形式存在
④密度按Li—Cs顺序依次递增
⑤离子半径:Rb+>K+>Na+
| A.①②③ | B.①③④⑤ | C.②④⑤ | D.①③⑤ |