对四种元素G、L、M、R进行如下实验:
| 金属 实验 |
G |
L |
M |
R |
| 和冷水反应 |
不反应 |
慢慢反应 |
未做实验 |
未做实验 |
| 和2 mol·L-1 盐酸反应 |
溶解并放 出气体 |
溶解并 放出气体 |
不反应 |
不反应 |
| 和Rn+的 水溶液反应 |
溶解并形 成沉淀 |
未做实验 |
溶解并 形成沉淀 |
未做实验 |
根据表中所给实验结果,判断这四种金属活泼性由强到弱的顺序正确的是( )
A.L、G、R、M B.G、L、M、R
C.L、G、M、R D.L、R、G、M
下图为装有活塞(质量忽略不计)的密闭容器,内盛22.4mL一氧化氮,若通入11.2mL氧气(气体体积均在标准状况下测定),保持温度压强不变,则容器内的密度为(提示:不考虑NO转化为NO2的可逆性)
| A.等于1.369 g·L-1 |
| B.等于2.054 g·L-1 |
| C.在1.369g·L-1和2.054g·L-1之间 |
| D.在2.054g·L-1和4.108g·L-1之间 |
等质量的两份锌粉a、b分别加入到两份相同体积相同物质的量浓度且过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,下列各图为产生H2的体积v(L)与时间t(min)的关系,其中正确的是
相同条件下,0.1mol/L Na2S2O3溶液和0.1mol/L H2SO4溶液各5mL,与10mL水混合,反应时间为t1s;0.2mol/L Na2S2O3溶液和0.2mol/L H2SO4溶液各5mL,与30mL水混合,反应时间为t2 s,则t1和t2的关系是(忽略体积变化)
| A.t1>t2 | B.t1<t2 | C.t1=t2 | D.不能肯定 |
蓄电池在放电时起原电池作用,在充电时起电解池的作用。下式是爱迪生蓄电池分别在充电和放电时的反应: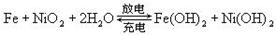
则下列有关对爱迪生蓄电池的推断错误的是
| A.放电时正极附近pH增大 |
B.充电时阴极的电极反应式为: 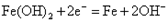 |
| C.放电时电解质溶液中的阴离子向正极方向移动 |
| D.蓄电池的电极可浸入某种碱性电解质溶液中 |
下列说法正确的是
| A.增大压强,使单位体积内活化分子数目增加,化学反应速率一定增大 |
| B.升高温度,使活化分子百分数增加,化学反应速率一定增大 |
| C.活化分子间所发生的分子间的碰撞均为有效碰撞 |
| D.加入反应物,使活化分子百分数增加,化学反应速率一定增大 |