已知断开1mol H—H键吸收的能量为436kJ,形成1mol H—N键放出的能量为391kJ,根据化学方程式N2+3H2 2NH3,反应完1mol N2放出的能量为92.4kJ,则断开1mol N≡N键需吸收的能量是( )
2NH3,反应完1mol N2放出的能量为92.4kJ,则断开1mol N≡N键需吸收的能量是( )
| A.431kJ | B.945.6kJ | C.649kJ | D.869kJ |
下列实验操作错误的是
| A.用药匙取用少量Na2SO4固体 |
| B.用胶头滴管滴加少量NaC1溶液 |
C.加热盛有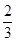 体积K2 SO4溶液的试管 体积K2 SO4溶液的试管 |
| D.用10 mL量筒量取8 mL1. 0 mol.L-1 NaOH溶液 |
打开汽水瓶盖时逸出大量气泡,气泡的主要成分为
| A.N2 | B.CO2 | C.O2 | D.H2 |
对元素周期表和元素周期律的发现有突出贡献的科学家是
| A.拉瓦锡 | B.阿伏加德罗 |
| C.门捷列夫 | D.道尔顿 |
用mol·L-1作为单位的物理量是
| A.长度 | B.质量 |
| C.物质的量 | D.物质的量浓度 |
下列制取气体的方法在实验室不可取的是
| A.铜和稀硝酸反应,排水法收集NO |
| B.锌和稀硝酸反应制氢气 |
| C.氮气和氧气反应制NO |
| D.加热氯化铵制取氨气 |