下列实验中,反应速率加快是由催化剂引起的( )
| A.在炭粉中加入KClO3,点燃时燃烧更为剧烈 |
| B.锌与稀硫酸反应中加入少量CuSO4溶液而使反应放出H2的速率加快 |
| C.固态FeCl3和固体NaOH混合后,加入水能迅速产生沉淀 |
| D.双氧水中加入少量MnO2,即可迅速放出气体 |
在体积恒定的密闭容器中,一定量的SO2与1.100molO2在催化剂作用下加热到600℃发生反应:2SO2 + O2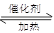 2SO3,ΔH<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是
2SO3,ΔH<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是
| A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 |
| B.降低温度,正反应速率减小程度比逆反应速率减小程度大 |
| C.将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980g |
| D.达到平衡时,SO2的转化率为90% |
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如右图所示。下列判断正确的是 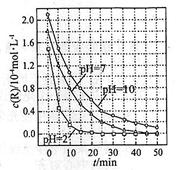
| A.在0-50min之间, pH ="2" 和 PH=" 7" 时 R 的降解百分率相等 |
| B.溶液酸性越强, R 的降解速率越小 |
| C.R的起始浓度越小,降解速率越大 |
| D.在 20-25min之间, pH =" 10" 时 R 的平均降解速率为 0.04mol·L-1·min-1 |
下列实验事实不能用平衡移动原理解释的是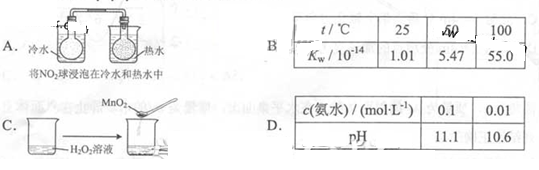
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)  MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
| 选项 |
x |
y |
| A |
温度 |
容器内混合气体的密度 |
| B |
CO的物质的量 |
CO2与CO的物质的量之比 |
| C |
SO2的浓度 |
平衡常数K |
| D |
MgSO4的质量(忽略体积) |
CO的转化率 |
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
 压强/MPa 压强/MPa 体积分数/% 体积分数/%温度/℃ |
1.0 |
2.0 |
3.0 |
| 810 |
54.0 |
a |
b |
| 915 |
c |
75.0 |
d |
| 1000 |
e |
f |
83.0 |
①b<f②915℃、2.0MPa时E的转化率为60% ③该反应的ΔS>0④K(1000℃)>K(810℃)
上述①~④中正确的有( )
A.4个 B.3个 C.2个 D.1个