在372K时,把0.5molN2O4通入体积为5L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为 0.02mol·L-1。在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
| A.前2s以N2O4的浓度变化表示的平均反应速率为0.01mol·L-1·s-1 |
| B.在2s时体系内压强为开始时的1.1倍 |
| C.在平衡时体系内含有N2O40.25mol |
| D.平衡时,N2O4的转化率为40% |
绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染。下列做法不符合绿色化学理念的是
| A.研制水溶剂涂料替代有机溶剂涂料 |
| B.用可降解塑料生产包装盒或快餐盒 |
C.用反应:Cu +2H2SO4(浓)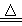 CuSO4+SO2↑+2H2O制备硫酸铜 CuSO4+SO2↑+2H2O制备硫酸铜 |
D.用反应: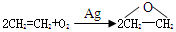 制备环氧乙烷 制备环氧乙烷 |
鲨鱼是世界上惟一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性。已知角鲨烯分子中含有30个碳原子及6个C=C且不含环状结构,则其分子式为
| A.C30H60 | B.C30H50 | C.C30H56 | D.C30H52 |
下列关于有机化合物的说法正确的是
| A.乙醇和乙酸都存在碳氧双键 |
| B.甲烷和乙烯都可以与氯气反应 |
| C.高锰酸钾可以氧化苯和甲烷 |
| D.乙烯可以与氢气发生加成反应,苯不能与氢气 |
下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是
| A.CH3CH2CH2CH3 | B.CH3CH(CH3)2 |
| C.CH3C(CH3)3 | D.(CH3)2CHCH2CH3 |
近期我国冀东渤海湾发现储量达10亿吨的大型油田。下列关于石油的说法正确的是
| A.石油属于可再生矿物能源 | B.石油主要含有碳、氢两种元素 |
| C.石油的裂化是物理变化 | D.石油分馏的各馏分均是纯净物 |