实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)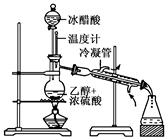
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是______________________________________。
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是:
__________________________________________________。
(3)在该实验中,若用1 mol乙醇和1 mol乙酸在浓硫酸作用下加热,充分反应,能否生成1 mol乙酸乙酯?________,原因是__________________________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。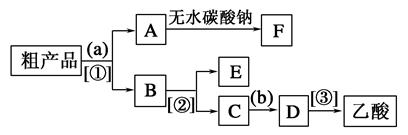
试剂a是__________,试剂b是__________;分离方法①是________,分离方法②是________,分离方法③是______。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是________________________________。

 金属铝的生产是以
为原料,在熔融状态下进行电解:
金属铝的生产是以
为原料,在熔融状态下进行电解:
请回答下列问题: (1)冰品石(
)的作用是。
(1)冰品石(
)的作用是。 (2)电解生成的金属铝是在熔融液的(填"上层"或"下层")。
(2)电解生成的金属铝是在熔融液的(填"上层"或"下层")。 (3)阴极和阳极均由材料做成;电解时所消耗的电极是(填"阳极"或"阴极")。
(3)阴极和阳极均由材料做成;电解时所消耗的电极是(填"阳极"或"阴极")。 (4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成(填代号)。
(4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成(填代号)。 a.冰品石 b.氧化铝 c.铝锭 d.硫酸铝
a.冰品石 b.氧化铝 c.铝锭 d.硫酸铝
干电池应用广泛,其电解质溶液是
混合溶液。 (1)该电池的负极材料是。电池工作时,电子流向(填"正极"或"负极")。
(1)该电池的负极材料是。电池工作时,电子流向(填"正极"或"负极")。 (2)若
混合溶液中含有杂质
,会加速某电极的腐蚀,其主要原因是。欲除去
,最好选用下列试剂中的(填代号)。
(2)若
混合溶液中含有杂质
,会加速某电极的腐蚀,其主要原因是。欲除去
,最好选用下列试剂中的(填代号)。 .
.
.
.
.
.
.
.
(3)
的生产方法之一是以石墨为电极,电解酸化的
溶液。阴极的电极反应式是 。若电解电路中通过2
电子,
的理论产量为。
。若电解电路中通过2
电子,
的理论产量为。
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。 (1)合成氨反应反应
(1)合成氨反应反应
 ,若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填"向左""向右"或"不");,使用催化剂反应的
(填"增大""减小"或"不改变")。
,若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填"向左""向右"或"不");,使用催化剂反应的
(填"增大""减小"或"不改变")。 (2)
(2)
 则反应
的
=
。
则反应
的
=
。 (3)在25℃下,向浓度均为0.1
的
和
混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为。已知25℃时
=1.8×10-11,
=2.2×10-20。
(3)在25℃下,向浓度均为0.1
的
和
混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为。已知25℃时
=1.8×10-11,
=2.2×10-20。
 (4)在25℃下,将
的氨水与0.01
的盐酸等体积混合,反应平衡时溶液
则溶液显性(填"酸""碱"或"中");用含
的代数式表示
的电离常数
=。
(4)在25℃下,将
的氨水与0.01
的盐酸等体积混合,反应平衡时溶液
则溶液显性(填"酸""碱"或"中");用含
的代数式表示
的电离常数
=。
四川汶川盛产品质优良的甜樱桃。甜樱桃中含有一种羟基酸(用
表示),
的碳链结构无支链,化学式为
;1.34 g
与足量的碳酸氢钠溶液反应,生成标准状况下的气体0.448 L。
在一定条件下可发生如下转化:



 其中,
、
、
、
分别代表一种直链有机物,它们的碳原子数相等。
的化学式为
(转化过程中生成的其它产物略去)。
其中,
、
、
、
分别代表一种直链有机物,它们的碳原子数相等。
的化学式为
(转化过程中生成的其它产物略去)。 已知:
已知:

的合成方法如下:
①


②
其中,
、
、
分别代表一种有机物。 请回答下列问题:
请回答下列问题:
 (1)
的结构简式是。
(1)
的结构简式是。 (2)
生成
的化学方程式是。
(2)
生成
的化学方程式是。
 (3)
与乙醇之间发生分子间脱水,可能生成的有机物共有种。
(3)
与乙醇之间发生分子间脱水,可能生成的有机物共有种。 (4)
的结构简式是。
(4)
的结构简式是。
 (5)写出
与水反应生成
和
的化学方程式:。
(5)写出
与水反应生成
和
的化学方程式:。
 新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(
)是新型锂离子电池的首选电极材料,它的制备方法如下:
新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(
)是新型锂离子电池的首选电极材料,它的制备方法如下: 方法一:将碳酸锂、乙酸亚铁[
]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
方法一:将碳酸锂、乙酸亚铁[
]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。 方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。 在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子选移的介质,该有机聚合物的单体之一(用
表示)的结构简式如下:
在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子选移的介质,该有机聚合物的单体之一(用
表示)的结构简式如下:

 请回答下列问题:
请回答下列问题: (1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是。
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是。 (2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有、
(2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有、 、(填化学式)生成。
、(填化学式)生成。 (3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为 。
。 (4)写出M与足量氧化钠溶液反应的化学方程式:
(4)写出M与足量氧化钠溶液反应的化学方程式: 。
。 (5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为。
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为。