已知温度T时,水的离子积常数为KW,该温度下将V1mL a mol/L的一元酸HA与V2mL b mol·L-1的一元碱BOH充分混合,下列判断一定正确的是
A.若V1a=V2b,稀释此混合溶液时,溶液中各离子浓度一定都发生变化
B.若pH( HA)+pH(BOH) =14,则V1=V2时,酸碱恰好完全中和
C.此混合液中: c( H+)+c(B+) ≤ c(OH一)+c(A一)
D.若混合溶液中。c(OH一) =√KWmol·L-1,则此溶液一定呈中性
如图所示,夹子开始处于关闭状态,将液体A滴人烧瓶与气体B充分反应,打开夹子,可发现试管内的水立刻沸腾了,则液体 A和气体B的组合不可能是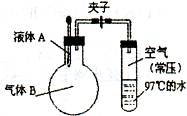
| A.水、氯化氢 |
| B.硫酸、氨气 |
| C.氢氧化钠溶液、二氧化硫 |
| D.氢氧化钠溶液、一氧化碳 |
列叙述中正确的有( )个
①有新单质生成的化学反应一定是氧化还原反应。②嫡增且放热的反应一定是自发反应。③Mg比A1活泼,在Mg和A1形成的原电池中,Mg必定做负极。④难溶电解质的溶度积越小,则它的溶解度越小。⑤燃烧热是指1 mol可燃物完全燃烧生成氧化物时所释放的能量。⑥干燥的C1:和氯水均能使鲜花褪色
| A.1 | B.2 | C.3 | D.4 |
室温下,下列图形与实验过程相符合的是
NA为阿伏伽德罗常数的值。下列叙述正确的是
| A.将28 g Fe投人到1 Ll mol/L的硫酸中,可得到11.2 LH2 |
| B.常温常压下,64 gSO2气体含有的原子数目为3 NA |
| C.25℃时pH =13的NaOH溶液中含有OH一的数目为0. 1 NA |
| D.1 mo1N a被完全氧化生成Na2O2,失去2 NA个电子 |