黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫和铁的化合物。
(1)冶炼铜的反应为: 8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是________(填代号)。
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
d.用浓硫酸吸收
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
根据以上信息回答下列问题:
a.除去Al3+的离子方程式是______________________。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为______________。证明炉渣中含有FeO的实验现象为______________________。
某有机物X的分子式为C4H8O2,X在酸性条件下与水反应,生成两种有机物Y和Z,Y在铜催化下被氧化为W,W能发生银镜反应.
(1)X中所含的官能团是________(填名称).
(2)写出符合题意的X的结构简式_______________________________________
________________________________________________________________________.
(3)若Y和Z含有相同的碳原子数,写出下列反应的化学方程式:Y与浓硫酸的混合物共热发生消去反应________________________________________________________
________________________________________________________________________.
W与新制Cu(OH)2反应_______________________________________________.
(4)若X的某种同分异构体能使石蕊变红色,可能有________种.
某有机物A中只含碳、氢、氧三种元素,相对分子质量为102,氢元素的质量分数为9.8%,分子中氢原子个数为氧的5倍.
(1)A的分子式为________.
(2)若A为酯类物质,在酸性条件下水解,生成两种相对分子质量相同的有机物,则A的结构简式可能为______________________.
(3)若A为羧酸,可由醇B氧化得到,A和B可以生成酯C,符合这些条件的酯只有________种,请写出其中一种酯的结构简式:__________________________.
(4)若A中有2个不同的含氧官能团,并含有2个甲基,不能发生消去反应的结构简式为:________________________________________________________________________.
已知A、B、C、D、E五种芳香化合物的分子式都是C8H8O2,请分别写出它们可能的结构简式,使其满足下列条件:
A水解后得到一种羧酸和一种醇;
B水解后也得到一种羧酸和一种醇;
C水解后得到一种羧酸和一种酚;
D水解后得到一种羧酸和一种酚,但这种酚跟由C水解得到的酚不是同分异构体;
E是苯的一取代衍生物,可以发生银镜反应.
试写出下列物质的结构简式:
A:____________;B:____________;C:____________;
D:____________;E:____________.
下图中X是一种具有水果香味的合成香料,A是直链有机物,E与FeCl3溶液作用显紫色.
请根据上述信息回答:
(1)H中含氧官能团的名称是________.B→I的反应类型为________.
(2)只用一种试剂鉴别D、E、H,该试剂是________.
(3)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为________________.
(4)D和F反应生成X的化学方程式为________________________________.
A、B、C、D、E均为有机化合物,它们之间的关系如下所示(提示:RCH===CHR′在KMnO4酸性溶液中反应生成RCOOH和R′COOH,其中R和R′为烷基)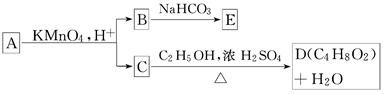
回答下列问题:
(1)直链化合物A的相对分子质量小于90,A分子中碳、氢元素的总质量分数为0.814,其余为氧元素,则A的分子式为________.
(2)已知B与NaHCO3溶液完全反应,其物质的量之比为1∶2,则在浓硫酸的催化下,B与足量的C2H5OH发生反应的化学方程式是__________________________,反应类型为________.
(3)A可以与金属钠作用放出氢气,能使溴的CCl4溶液退色,则A的结构简式是____________________.
(4)D的同分异构体中,能与NaHCO3溶液反应放出CO2的有________种,其相应的结构简式为________.