用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH;甲基橙变色范围为3.1~4.4)。下列判断正确的是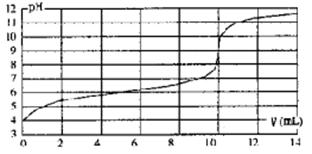
| A.HA的浓度为l×10-4mol·L-1 |
| B.实验时可选甲基橙作指示剂 |
| C.V=10mL,酸碱恰好中和 |
| D.pH=7时,溶液中c(Na+)>c(A-) |
如图是元素周期表短周期的一部分,已知B原子与C原子核外电子总数和为A原子核外电子总数的4倍,则以下推断正确的是()
| A |
||
| B |
C |
A.三者皆为非金属元素
B.B与A、B与C均可以形成离子化合物
C.三者核电荷数之和为40
D.B与C只能形成一种共价化合物
下列离子方程式中正确的是()
| A.将金属钠加入水中 Na + 2H2O= Na+ + 2OH- + H2 ↑ |
B.氯气通入水中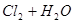  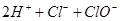 |
| C.FeBr2溶液中加入过量的新制氯水 2Fe2++4Br-+3Cl2 =2Br2+6Cl-+2Fe3+ |
| D.氯化铝溶液中加入过量氨水 A13++4NH3·H2O A1O2-+4NH4++2H2O |
常温下,某未知溶液中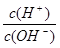 =1×1012,且含有大量Al3+和NO3-,检验此溶液中是否大量存在以下6种离子:①SiO32-②NH4+③Fe2+④Na+⑤HCO32-⑥Cl-,其中不必检验就能加以否定的离子是
=1×1012,且含有大量Al3+和NO3-,检验此溶液中是否大量存在以下6种离子:①SiO32-②NH4+③Fe2+④Na+⑤HCO32-⑥Cl-,其中不必检验就能加以否定的离子是
()
| A.①③⑤ | B.②③④ | C.①②⑥ | D.④⑤⑥ |
下列关于阿佛加德罗常数(NA)说法正确的是()
| A.常温常压下,当活泼金属转移2NA个电子时,可从盐酸中置换产生22.4LH2 |
| B.1mol氯气与足量的氢氧化钠反应,共转移了NA的电子 |
| C.标准状况下, 2.24L甲烷和氨气的混合气中所含的电子数为NA |
| D.1mol/L的Na2S溶液中,含有的S2-的数目小于NA |
关于如图所示装置的叙述,正确的是()
| A.铜是阳极,铜片上有气泡产生 | B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 | D.氢离子在铜片表面被还原 |