根据水溶液中存在的平衡关系,判断下列说法正确的是
| A.往水中滴加少量氢氧化钠稀溶液,Kw变小 |
| B.往AgCl悬浊液中加入0.1mol·L-1NaI溶液,无明显现象产生 |
| C.室温下,稀释0.1mol·L-1的醋酸,溶液中c(CH3COO-)·c(H+)不变 |
| D.等体积等浓度的氨水与盐酸混合后所得溶液显酸性 |
下列说法正确的是()
①离子化合物一定含离子键,也可能含极性键或非极性键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物一定是离子化合物
| A.①③⑤ | B.②④⑥ | C.②③④ | D.①③⑥[ |
可能存在的第119号元素,有人称“类钫”,据周期表结构及元素性质变化趋势,有关“类钫”的预测说法正确的是()
| A.“类钫”在化合物中呈+1价 | B.“类钫”属过渡元素,具有放射性 |
| C.“类钫”单质的密度小于1g/cm3 | D.“类钫”单质有较高的熔点 |
可逆反应:2NO2(g)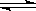 2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是:()
2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是:()
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态
④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再变化
| A.①④⑥ | B.②③⑤⑥ | C.①③④⑥ | D.①②③④⑤ |
下列关于化学键说法正确的是: ( )
| A.构成单质分子的微粒中不一定含有化学键 |
| B.只含有共价键的物质一定是共价化合物 |
| C.NaCl溶于水破坏了离子键,乙醇溶于水破坏了共价键 |
| D.CaCl2中既有共价键又有离子键 |
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是:( )
A.CO2的电子式: |
B.CH4分子的比例模型: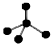 |
C.NH4Cl的电子式: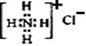 |
D.原子核内有10个中子的氧原子: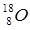 |