有人建议将氢元素排在元素周期表的ⅦA族。下列事实能支持这一观点的是( )。
①H原子得到一个电子实现最外电子层稳定结构;
②氢分子的结构式为H—H;
③与碱金属元素形成离子化合物:M+[:H]-
④分子中原子间的化学键都属于非极性键
| A.①②③ | B.①③④ | C.②③④ | D.①②③④ |
下列递变规律正确的是
| A.O、S、Na、K的原子半径依次增大 |
| B.Na、Mg、Al、Si的金属性逐渐增强 |
| C.HF、HCl、H2S、PH3的稳定性依次增强 |
| D.KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强 |
门捷列夫在绘制元素周期表时许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素(与硅处于同族),后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是
| A.X单质不易与水反应 | B.XO2可被碳还原为X |
| C.XH4的稳定性比SiH4的高 | D.X的半径比Si的大 |
下列说法正确的是
| A.KOH中既含离子键,也含共价键,属于离子化合物 |
| B.N2属于单质,不存在化学键 |
| C.MgCl2中既含离子键,也含共价键 |
| D.NH4Cl由非金属元素组成,属于共价化合物 |
下列各图为周期表的一部分。表中数字为原子序数,其中M为37的是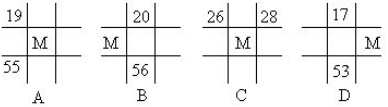
C6H14的各种同分异构体中所含甲基数和它的一氯代物的数目可能是
| A.2个甲基,能生成4种一氯代物 | B.3个甲基,能生成3种一氯代物 |
| C.3个甲基,能生成4种一氯代物 | D.4个甲基,能生成4种一氯代物 |