四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则下列叙述正确的是( )。
①a-b=n-m ②元素的原子序数:a>b>c>d ③元素非金属性:Z>R ④最高价氧化物对应的水化物的碱性:X>Y
| A.只有③ | B.①②③④ | C.①②③ | D.②③ |
室温下,取0.2mol/L H2 A溶液与xmol/L NaOH溶液等体积混合(忽略混合后溶液体积变化),测得混合溶液的pH=y,下列推断不正确的是
| A.当x=0.2,则混合溶液中y可能大于7或小于7 |
| B.当x=0.2,y=1,则混合溶液中:c(H+)=c(A-)+c(OH-) |
| C.当x=0.3,y>7,则混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) |
| D.当x=0.4,则混合溶液中:[c(Na+)+c(H+)]>2c(A2-) |
已知甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如下: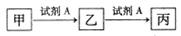
下列说法不正确的是
| A.若乙为NaHCO3,则丙一定是CO2 |
| B.若A为氯水,X为金属元素,则甲与丙反应可生成乙 |
| C.若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀 |
| D.若甲为单质硫,则丙溶于水形成的浓溶液能与碳反应可生成乙 |
下列图示与对应的叙述不相符的是
| A.图1表示氢氧燃料电池构造示意图 |
| B.图2表示室温下pH=2的HCl溶液加水稀释倍数与pH的变化关系 |
| C.图3表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| D.图4表示向NH4 Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,生成沉淀总物质的量(n)随着Ba(OH)2溶液体积(y)的变化 |
X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如右图所示。X的最高价氧化物和气态氢化物的分子都是由极性键形成的非极性分子。下列性质比较中正确的是
| A.最高价氧化物的水化物的酸性:Y<X<W |
| B.离子半径由小到大的顺序:W<Z<Y |
| C.单质晶体的熔点由低到高的顺序:Y<W<Z |
| D.原子最外层的电子数:Z<Y<X |
用下列装置进行的实验中,能达到其实验目的的是.
| A.用装置①制取并收集干燥纯净的NH3 |
| B.用装置②分离苯萃取碘水后已分层的有机层和水层 |
| C.用装置③配制一定的物质的量浓度的稀硫酸 |
| D.用装置④测定锌与稀硫酸反应的速率 |