A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)这四种元素分别是:A________,B________,C________,D________。
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是________。
(3)A与B形成的三原子分子的电子式是________,B与D形成的原子个数比为1∶1的化合物的电子式是________。
(4)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是____________________________。
下图表示各物质之间的转化关系。已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。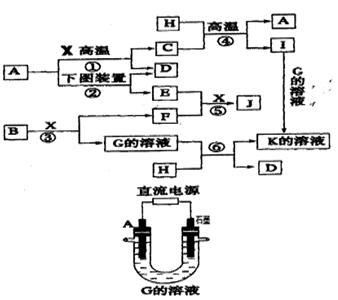
请按要求填空:
(1)反应⑤的现象是。反应③中若转移3NA电子,则被氧化的B是mol
(2)反应①的化学方程式是,在实验室中引发反应④的操作是。
(3)实验室用上图中的电解池制备E,与A相连的直流电源的电极名称为
A电极的电极反应式,下列溶液能代替G溶液的是。
A.稀硫酸 B.NaCl溶液 C.K2CO3溶液 D.CuCl2溶液
(4)现有J与稀硝酸恰好完全后的溶液
①在上述溶液中加入少量HI溶液的离子方程式为
②若要从上述溶液中得到晶体,正确的操作为:先,再降温结晶,过滤即可得所需晶体。
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HC1挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。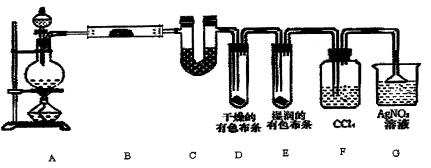
(1)若用含有0.2 mol HC1的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是。
(2)①装置B中盛放的试剂名称为,作用是。
装置C中盛放的试剂名称为,作用是 。
。
②装置D和E中出现的不同现象说明的问题是。
③装置F的作用是____。
④写出装置G中发生反应的离子方程式。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在与之间(填装置字母序号),装置中应放入(填写试剂或用品名称)
高中化学学习阶段,氨的催化氧化反应也可用某金属M(相对原子质量<100)的氧化物做催化剂。M元素的离子在一定条件下能与NH3、卤离子等按某固定比例牢牢结合成稳定的配合物离子(类似于原子团)。
(1)150℃、常压下,6.08g该氧化物与0.6mol HCl气体充分发生复分解反应后,氧化物无剩余,气体变为0.48mol。该金属M的相对原子质量为___________。
将上述反应所得固体溶于水配成50.0mL溶液,该溶液中溶质的物质的量浓度为
_______mol·L-1。
(2)取(1)中所配溶液12.5mL,稀释至25mL,缓缓通入2688mL氨气(标况下),在一定条件下反应恰好完全,得到产物B(摩尔质量为260.5g/mol),继续用1.5mol/L的AgNO3溶液滴定,达到终点时,耗去AgNO3溶液40.0mL。将B投入过量烧碱溶液中,未检测出NH3的逸出。则B的化学式可表示为。
(3)已知在下图中,L的位置完全相同。现有另一种配离子[M(NH3)6-xClx]n±(1≤x≤5,且x为整数),结构类似下图。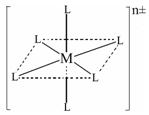
如果该配离子共有2种不同结构,该配离子的式量为。
(4)一定条件下,3.04g该金属氧化物恰好被某氧化剂(效果相当于0.03mol O2)氧化,再加入0.05mol KCl,经一些特殊工艺处理,K、M两元素恰好完全形成含氧酸盐(式量<360),且盐内部阴阳离子个数比为1:2。则该盐的式量以及物质的量分别为_______________。
A、B、C、D、E、F、G、H、I、J 均为有机化合物,其转化关系如下图所示。已知B 和 C 均为有支链的有机化合物;C在反应③中只能生成一种有机产物;G 能使溴的四氯化碳溶液褪色。回答问题:
能使溴的四氯化碳溶液褪色。回答问题:
(1)G的结构简式:____________________。⑦的反应类型____________________。
(2)步骤⑤的化学方程式 ______________________________________________。
(3)A在隔绝加热条件下可发生消去反应得到D ,请写出该消去反应中除D外的另一个产物的结构简式__________________________。
,请写出该消去反应中除D外的另一个产物的结构简式__________________________。
(4)步骤④中的“Cl2、光”能否改为“饱和氯水”?请说明原因:__________
(5)写出与H 具有相同官能团的同分异构体的结构简式______________________
(6)在一定条件下,酯与醇会发生酯交换,生成新的酯和醇。请尝试书写I与F发生的酯交换反应方程式:_____________________________________________________。
(7)一定条件下,G和H发生1:1聚合,聚合产物有多种。写 出其中两种聚合产物的结构简式:____________________________________________________________。
出其中两种聚合产物的结构简式:____________________________________________________________。
已知烃基烯基醚水解反应:R-CH=CH-O-R′ 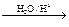 R-CH2CHO + R′OH。烃基烯基醚A的式量为176,分子中碳氢原子数目比为3∶4 。有机物B的式量为60。相关的反应如下。请回答下列问题:
R-CH2CHO + R′OH。烃基烯基醚A的式量为176,分子中碳氢原子数目比为3∶4 。有机物B的式量为60。相关的反应如下。请回答下列问题: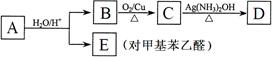
⑴ A的结构简式为________________________,B的名称是___________________。
⑵写出B → C反应的化学方程式:________________ _______________________。
_______________________。
⑶写出两种符合下列条件的E的同分异构体的结构简式:__ ___________________。
___________________。
① 属于芳香醛; ② 苯环上有两种不同的氢原子。
⑷由E转化为对甲基苯乙炔(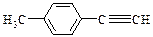 )的一条路线如下:
)的一条路线如下: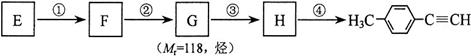
(I)写出G的结构简式:_____________________________。
(II)步骤②所加试剂及反应条件为:____________。步骤④的反应类型为:________。