在25 ℃、101 kPa的条件下,断裂1 mol H—H键吸收436 kJ能量,断裂1 mol Cl—Cl键吸收243 kJ能量,形成1 mol H—Cl键放出431 kJ能量。H2+Cl2===2HCl的化学反应可用下图表示: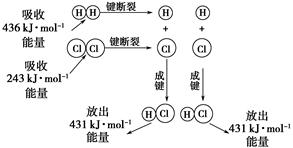
请回答下列有关问题:
(1)反应物断键吸收的总能量为________。
(2)生成物成键放出的总能量为________。
(3)判断H2+Cl2===2HCl是________(填“吸收”或“放出”)能量。
(4)反应物的总能量________(填“>”,“=”或“<”)生成物的总能量。
2014年8月28日,第二届夏季青年奥林匹克运动会(以下简称“青奥会”)在南京奥体中心顺利闭幕。请完成下列与“青奥会”有关的填空。
(1)随着“青奥会”的举行,各种与城市建设相关的新材料接连不断地展现出来。
①体育场馆需用大量的建筑材料。下列材料不属于硅酸盐材料的是 (填字母)。
a.石灰石 b.水泥 c.玻璃
②轨道交通建设需大量金属材料。下列金属材料最易发生腐蚀的是 (填字母)。
a.铝合金 b.钢铁c.纯铜
③聚乙烯、聚氯乙烯都是线型高分子树脂,它们制成的塑料具有 (选填“热塑性”或“热固性”)。
(2)“青奥会”期间,要保障运动员的营养与健康。
①及时补充体能是运动员取得优秀成绩的基本保证。氨基酸是组成蛋白质的基本单元,其分子中所含官能团是氨基和 (填名称);脂肪在人体内水解的产物是高级脂肪酸和 (填名称)。
②运动员还要合理吸收维生素。维生素C的结构简式如图所示,其分子式为 ;在氯化铁溶液中加入维生素C后,溶液由黄色转变为浅绿色,说明维生素C具有较强的 性(填“氧化”或“还原”)。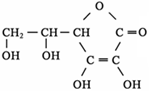
③服用违禁药物不仅妨碍体育竞技的公平、公正,也有害运动员的身心健康。在阿司匹林、青霉素、麻黄碱、小苏打等常用药物中,参赛选手不可服用的是 。
(3)“绿水蓝天”工程为运动员提供了优良的环境,向世界展示了古都南京的美好形象。
①用明矾处理废水中细小悬浮颗粒的方法属于 (填字母)。
a.混凝法b.中和法c.氧化还原法
②PM2.5悬浮于大气中的直径≤2.5 μm(微米)的颗粒物,大量PM2.5会造成灰霾天气。燃煤气化有助于控制PM2.5排放,写出焦炭与水蒸气反应的化学方程式 。
③向煤中加入石灰石作为脱硫剂,可以减少SO2的排放,生成CaSO4。发生的总反应化学方程式为 。
避蚊酯(DMP)是一种塑化剂,相对分子质量为194,摄入后对人体有一定的危害,其结构可表示为
请回答:
(1)物质C中官能团的名称为________。
(2)下列有关DMP的说法可能正确的是________(填字母标号)
A.DMP的分子式为C10H12O4
B.DMP可以发生取代、加成、氧化等反应
C.DMP在水中的溶解度不大
(3)B与乙二酸( )在一定条件下可以按物质的量1∶1发生反应生成高分子化合物,该高分子化合物的结构简式为____________________________。
)在一定条件下可以按物质的量1∶1发生反应生成高分子化合物,该高分子化合物的结构简式为____________________________。
(4)工业上以邻二甲苯( )为原料先生产苯酐(
)为原料先生产苯酐( ),再使其与某醇在一定条件下反应制取DMP。苯酐与该醇制取DMP的化学方程式为_______________。
),再使其与某醇在一定条件下反应制取DMP。苯酐与该醇制取DMP的化学方程式为_______________。
(5)芳香化合物E与C互为同分异构体,若1 mol E与足量银氨溶液反应生成2 mol Ag,则E可能的结构简式为________。B也存在多种同分异构体,符合下列条件的B同分异构体有________种。
①1 mol有机物可以与2 mol NaOH反应
②苯环上的一氯代物只有一种。
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+ O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+ O2(g)===CO2(g)ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g)ΔH=-283.0 kJ·mol-1
H2(g)+ O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g)  CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,
在催化剂作用下反应生成甲醇,
平衡转化率与温度、压强的关系如图所示。
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。
请写出开始时阳极反应的电极反应式________________。
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下(金属单质E可由滤液C制取):已知:Cu2O+2H+===Cu2++Cu+H2O。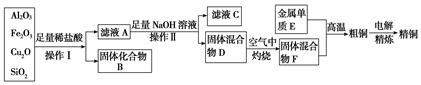
(1)滤液A中铁元素的可能存在形式为________(填离子符号),与之相关的离子方程式为;。
若滤液A中存在Fe3+,检验该离子的试剂为________(填试剂名称)。
(2)写出E和F反应生成铜的化学方程式为。
(3)利用电解法进行粗铜精炼时,下列叙述正确的是________(填序号)。
a.若用硫酸铜溶液作电解液, 向阴极移动
向阴极移动
b.粗铜接电源正极,发生还原反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.当粗铜消耗6.4 g时,转移0.2NA个电子
Z、Y、X、W、V是原子序数依次增大的五种常见元素。X元素是地壳中含量最多的元素,Y、Z组成的气态化合物M的水溶液呈碱性,W的单质在X2中燃烧产物可使品红溶液褪色,V是一种历史悠久、应用广泛的金属元素。请回答:
(1)Y元素在周期表中的位置是;M的分子空间构型为形,M是分子(“极性”或“非极性”)
(2)写出X、Z两种元素组成的化合物Z2X2的结构式:。
(3)由以上五种元素两两组合所形成的化合物中,有一种物质能与水反应生成气体且反应属于氧化还原反应,请写出该反应的化学方程式。
(4)X、Y、Z三种元素可组成一种强酸U,M与U反应生成一种盐K,写出K中含有的化学键类型。
(5)若将V金属投入到盐酸溶液中,生成了浅绿色溶液N。N的酸性溶液与双氧水反应的离子方程式:。