某酯的结构中存在“C-18O-C”结构,则合成该酯的原料不应该是 ()
A.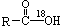 |
B. |
C.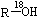 |
D. |
某有机物其结构简式如图所示,关于该有机物下列叙述不正确的是()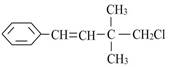
| A.能与NaOH的醇溶液共热发生消去反应 |
| B.能使溴水褪色 |
| C.一定条件下,能发生加聚反应 |
| D.一定条件下,能发生取代反应 |
某有机物可被氧化为甲、也可被还原为乙,甲和乙都能跟钠反应放出氢气,且甲、乙在浓硫酸催化下反应生成丙,丙能发生银镜反应,丙的结构简式是()
| A.CH3COOCH3 | B.HCOOCH3 | C.HCOOCH2CH3 | D.HCOOCH2CH2CH3 |
下列哪一种试剂可以鉴别乙醇、乙醛、乙酸、甲酸四种无色溶液 ( )
| A.银氨溶液 | B.浓溴水 | C.新制Cu(OH)2浊液 | D.FeCl3溶液 |
某化合物6.4g在氧气中完全燃烧,只生成8.8g CO2和7.2 g H2O。下列说法正确的是
| A.该化合物仅含碳、氢两种元素 | B.该化合物中碳、氢原子个数比为1:4 |
| C.无法确定该化合物是否含有氧元素 | D.该化合物一定是C2H8O2 |