下列是海水综合应用中提取镁、溴的反应,属非氧化还原反应的是
| A.苦卤中加入石灰乳MgCl2+ Ca(OH)2 = CaCl2 +Mg(OH)2 |
| B.苦卤中通入氯气2Br- + Cl2 = 2Cl- + Br2 |
C.氯碱工业电解食盐水2NaCl + 2H2O 2NaOH + H2↑+ Cl2↑ 2NaOH + H2↑+ Cl2↑ |
D.电解氯化镁MgCl2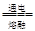 Mg + Cl2↑ Mg + Cl2↑ |
已知:
CH4(g)+2O2(g)=2CO2(g)+2H2O(l)△H=-Q1
2H2(g)+O2(g)=2H2O(g)△H=-Q2
2H2(g)+O2(g)=2H2O(l)△H=-Q3
常温下取体积比为4:1的CH4和H2的混合气体11.2L(标况)经完全燃烧后恢复至常温,放出的热量是
| A.0.4Q1+0.05Q3 | B.0.4Q1+0.05Q2 | C.0.4Q1+0.1Q3 | D.0.4Q1+0.2Q2 |
丙烯酸的结构简式为CH2=CH—COOH,其对应的性质中不正确的是
| A.与钠反应放出氢气 | B.与新制的Cu(OH)2悬浊液反应 |
| C.能与溴水发生取代反应 | D.能发生反应生成高分子化合物 |
将甲、乙两种金属的性质相比较,已知
①甲跟水反应比乙与水反应 剧烈
剧烈
②甲单质能从乙的盐溶液中置换出单质乙
③甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强
④与某金属反应时甲原子得电子数目比乙的多
⑤以甲、乙金属为电极构成原电池,乙作负极
能说明甲的金属性比乙强的是
| A.①④ | B.③⑤ | C.①②③ | D.①②③④⑤ |
在2L容器中发生反应N2+3H2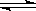 2NH3,经一段时间
2NH3,经一段时间 后NH3的物质的量增加了2.4 mol,这段时间内用氢气表示的反应速率为0.6mol·L-1·s-1,则这段时间为
后NH3的物质的量增加了2.4 mol,这段时间内用氢气表示的反应速率为0.6mol·L-1·s-1,则这段时间为
| A.6 s | B.4 s | C.3 s | D.2 s |
下列对热化学方程式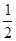 H2(g)+
H2(g)+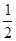 I2(g)══HI(g) ΔΗ="+26" kJ·mol-1的叙述中,正确的是
I2(g)══HI(g) ΔΗ="+26" kJ·mol-1的叙述中,正确的是
| A.1 mol氢气和1 mol碘蒸气完全反应需要吸收26 kJ的热量 |
| B.1个氢分子和1个碘分子完全反应需要吸收52 kJ的热量 |
| C.1 mol H2(g)与1 mol I2(g)完全反应生成2 mol的HI气体需吸收52 kJ的热量 |
D.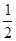 mol H2(g)与 mol H2(g)与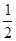 mol I2(g)完全反应放出26 kJ的热量 mol I2(g)完全反应放出26 kJ的热量 |