下列实验操作与对应的反应现象或原理正确的一组是( )
| 选项 |
实验操作 |
现象或原理 |
| A |
取少量KI溶液,先滴加氯水,再加入少量苯,振荡、静置 |
溶液分层,下层呈紫红色 |
| B |
将稀盐酸或氢氧化钠溶液慢慢滴入氢氧化铝胶体中 |
均先沉淀后溶解 |
| C |
将浓硝酸加入盛有铂、金的烧杯中,不反应,加入一定量浓盐酸后,铂、金溶解 |
浓盐酸氧化性强于浓硝酸 |
| D |
将40.0 g NaOH固体溶于1.0 L蒸馏水中配成溶液 |
溶液物质的量浓度为1.0mol﹒L-1 |
下列说法不正确的是
| A.发展核电、煤中加入生石灰、利用二氧化碳制造全降解塑料都能有效减少环境污染 |
| B.物质变化中炭化、钝化、皂化、酯化、熔化都属于化学变化 |
| C.氢键、分子间作用力、离子键和共价键均为微粒间的相互作用力 |
| D.农业废弃物、城市工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能 |
下列变化过程中,没有发生化学变化的是
| A.用蒸馏法淡化海水 | B.从海带中提取碘 |
| C.石墨转化为金刚石 | D.氨气溶解在水中 |
下图是a、b两种固体物质的溶解度曲线,下列说法中,正确的是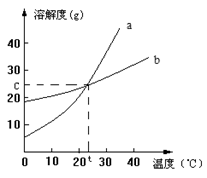
| A.a的溶解度大于b的溶解度 |
| B.在t℃时,a、b的饱和溶液中溶质的物质的量浓度相同 |
| C.升高温度时,a、b溶解度均增大 |
| D.在t℃时,将a、b的饱和溶液升温后,溶质的质量分数:a﹥b |
下列物质不能通过化合反应生成的是
| A.NaOH | B.NaHCO3 | C.FeCl2 | D.Al(OH)3 |
下列关于有机物的叙述正确的是
| A.乙醇不能发生取代反应 | B.C4H10有三种同分异构体 |
| C.淀粉和纤维素互为同分异构体 | D.乙烯和甲烷可用溴的四氯化碳溶液鉴别 |