已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。常温常压下,E单质是淡黄色固体,常在火山口附近沉积。
(1)D在元素周期表中的位置为____________,C和E离子半径大小比较______________。
(2)A2E的燃烧热ΔH = -a kJ/mol,写出A2E燃烧反应的热化学方程式:_______________。
(3)CA的电子式为 ___________;AB形成的晶体熔点_______。(填“大于”“小于”或“无法判断”)CE形成的晶体熔点。
(4)甲、乙、丙分别是B、D、E三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应的产物不同。写出向丙溶液中缓慢滴加过量的乙溶液过程中反应的离子方程式:________ 。
体内的葡萄糖代谢有如下过程: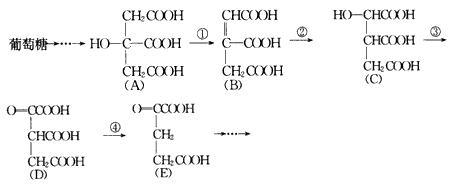
请填空:(1)过程①是____反应,过程②是____ 反应,过程③是___反应(填写反应类型的名称)。
(2)过程④的另一生成物是___(填写化学式)。
(3)上述物质中___和___互为同分异构体 (填代表物质的字母)
(1)下列五种物质中,①Ar ② CO2 ③ SiO2 ④ Ba(OH)2 ⑤ K2S,
含有共价键的物质有_______________________________ (填序号)
分别写出 CO2 、 Ba(OH)2的电子式_______________________________
(2)在蔗糖溶液中加入稀硫酸并加热,稀硫酸的作用_____________________________
向上述溶液中加入新制的Cu(OH)2悬浊液,加热未见砖红色沉淀,其原因是_______________________________
(3)请用下列物质的转化或分离方法的序号填空(每一项只填写一种方法)。
①溶解 ②裂解 ③分馏 ④裂化 ⑤干馏 ⑥蒸馏 ⑦电解 ⑧过滤 ⑨萃取
把煤转化为焦炉气、煤焦油和焦炭等_______________________________
从原油中分离出汽油、煤油、柴油等_______________________________
将重油转化为汽油_______________________________
将海水淡化_______________________________  从海水得到的无水MgC12中提取金属镁
从海水得到的无水MgC12中提取金属镁
(4)乙烯和丙烯(C3H6)既可以分别发生加聚反应形成聚合物,也可以按一定比例相互发生加聚反应形成聚合物。
请写出三种有关聚合物的结构简式、、
(5)形成该聚合物 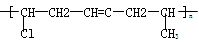 的单体有 ______________________________
的单体有 ______________________________
(6)某离子晶体的晶胞结构如图所示。试求: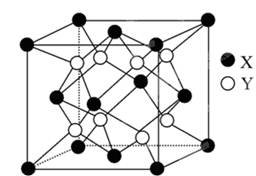
(1)晶体中每一个X同时吸引着________Y,每个Y同时吸引着________个X,该晶体的化学式是________________________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有________个。
(3)晶体中距离最近的2个X与一个Y形成的夹角(∠XYX)为________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ g·cm-3,阿伏加德罗常数为NA,则晶体中两个距离最近的X的核间距离为________cm。
原子序数依次增大的短周期元素A、B、C、D、E、F,其中 A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,F能形成与A相同价态的阴离子,且A离子半径小于F离子。回答:
(1)B元素的名称为。
(2)A与F可形成两种中学化学常见的化合物,其分子式分别为和;分子空间构型分别为。
(3)请写出基态原子E的价电子排布式
(4)上述六种元素按电负性从大到小的排列是(写元素符号表示)。
(5)C、D、E、F元素第一电离能从小到大的排列是(写元素符号);
(6)A、B、C、D四种元素的简单离子按半径由小到大的顺序为(用离子符号表示)__________________________。
(7)C与A形成的化合物属于晶体,此化合物和NaCl固体相比较熔点的高低关系为
(用化学式表示大小关系),原因是。
下表为元素周期表的一部分,期中的编号代表对应的元素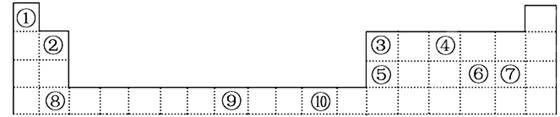
请回答下列问题:
(1)表中属于ds区的元素是________(填编号)。
(2)写出元素⑨的高价离子的电子排布式_____________________________。
(3)某元素的最外层电子排布式为nsnnpn+1,该元素原子的核外共有________种不同运动状态的电子。该元素在周期表中的位置是上表中相对应的(填编号),该元素的气态氢化物沸点较高的原因是
(4)⑥、⑦分别①形成的化合物稳定性较强的为(化学式表示)