炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉(Cd)是一个有益的尝试,其流程如下:
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7。试回答下列问题:
(1)浸出时用到的试剂X为 , 写出溶解过程中加快浸出速率和提高浸出率的两点措施:_______________________________,______________________________。
(2)写出加入Ca(ClO)2反应的离子方程式 。
(3)调节pH过程可以选用 (填“ZnO”或“NaOH”);本流程的pH调节一般调至5,其目的是 。
(4)写出过滤后加入过量的锌粉反应的离子方程式 。
(5)在蒸发浓缩操作时,要采取实验措施是: 。
①②③④⑤五种元素,在元素周期表中的位置如图所示。回答下列问题: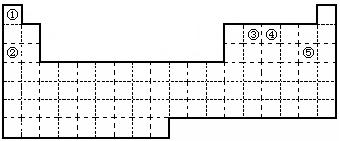
(1)①②③④⑤五种元素中,金属性最强的元素位置是(填周期和族),该元素的单质在空气中燃烧的化学方程式为。
(2)元素①和③可以形成众多的化合物,其中最简单的是(写化学式),
该化合物中,化学键的类型为(填“离子键”或“共价键”)。
(3)画出元素④的原子结构示意图,该元素的最高价氧化物的水化物能与Cu发生反应,反应中作氧化剂的是(写化学式)。
(4)写出元素⑤单质分子的电子式,其单质在常温下为黄绿色的气体,实验中可以用NaOH溶液吸收,反应的离子方程式为。
若将苯倒入盛有溴水的试管中,振荡后静置,现象是,说明苯;若将碘晶体、食盐固体分别加入盛有苯的试管中,振荡后静置,现象是。
干电池是一种的装置。干电池外围的锌皮是电池的极,发生(“氧化” 或“还原” )反应;中间碳棒是电池的极,发生(“氧化” 或“还原” )反应。
淡黄色固体X和气体A存在如下转化关系:
请回答下列问题:
(1)固体X的名称A的化学式。
(2)写出反应①的化学方程式,并指出氧化剂。
,。
(3)写出②④反应的离子方程式:
反应②。
反应④。
电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)写出FeCl3溶液与铜箔发生反应的化学方程式:;若反应过程中有2 mol电子发生转移,会有g Cu溶解。
(2)某工程师为了从使用过的腐蚀废液(不含FeCl3)中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤: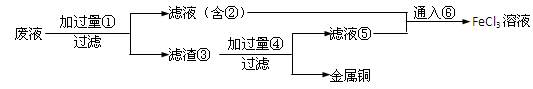
请写出上述试验过程中②⑤的化学式:
②,⑤。
请写出①⑥两步反应的离子方程式:;
。