甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用两种方法制备甲醇:
反应Ⅰ:CO(g) + 2H2 (g)  CH3OH (g) DH1
CH3OH (g) DH1
反应Ⅱ:CO2(g)+ 3H2(g)  CH3OH (g)+H2O(g) DH2
CH3OH (g)+H2O(g) DH2
① 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断DH1_______________0(填“<”、“=”或“>”)。
② 某温度下,将2molCO和6molH2充入2L密闭容器中充分反应,4分钟后反应达到平衡,测得CO的物质的量为0.4mol,则CO的反应速率为________________,此时的压强是反应前压强的___________倍。
(2)反应Ⅱ的平衡常数表达式为____________________,为了加快反应Ⅱ的反应速率,并且提高H2的转化率,采取的措施是_______________(填写正确选项的字母)。
a.增大CO2的浓度 b.增大H2的浓度
c.增大压强 d.加入催化剂
(3)工业上利用CO与水蒸气的反应,将有毒的CO转化为无毒的CO2,书写有关热化学反应方程式__________________________________。该反应在830K下进行时,初始浓度到达平衡的时间有如下的关系:
| CO的初始浓度(mol/L) |
2 |
4 |
1 |
3 |
| H2的初始浓度(mol/L) |
3 |
2 |
3 |
3 |
| 时间(min) |
8 |
6 |
12 |
n |
则n 为________min。
(4)近年来,科研人员新开发出一种甲醇和氧气以强碱溶液为电解质溶液的新型手机电池。该电池中甲醇发生反应的一极为______极、其电极反应式为_________________。
(5)用该电池作电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为 L。
高炉炼铁中发生的基本反应如下:FeO(s)+CO(g)s Fe(s)+CO2(g)△H>0。
Fe(s)+CO2(g)△H>0。
(1)下列可以作为判断该反应已经达到化学平衡状态依据的是。
a.高炉内压强不变
b.CO2的生成速率和CO的生成速率相等
c.混合气体中CO2的浓度不变
d.c(CO2)=c(CO)
(2)此反应的平衡常数表达式为K=。
(3)温度升高平衡常数K值(填“增大”“减小”、或“不变”)。
(4)已知1100℃时,K=0.263,此时测得高炉中c(CO2)="0.025mol/L" ·c(CO)=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态(填“是”或“否”),此时化学反应速率是
 (填“<”、“>”或“=”),其原因是。
(填“<”、“>”或“=”),其原因是。
A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去)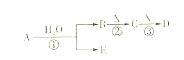
(1)若D为白色胶状难溶物,且与A摩尔质量相等,则反应③的离子方程式为:。
(2)若A为CO,则D的化学式为。
(3)若C为当今需要减排的一种常见的温室气体,E为一种弱酸,则A的化学式为。
(10分)有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+ Na+ Cu2+ Al3+ |
| 阴离子 |
SO42— HCO3— NO3— OH— |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生
白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B,D 。
(2)将含1molA的溶液与含1molE的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为。
(3)在A溶液中加少入量澄清石灰水,其离子方程式为。
(4)C常用作净水剂,用离子方程式表示其净水原理。
(10分)有下图所示的反应关系,A是中学常见的无机物,A、B、C中含有同一种元素R,不含R的元素已经略去。
(1)若A与NaOH按不同物质的量比反应,既可只生成B,又可只生成C,还可生成B+C。
①写出符合上述反应关系的A的化学式。
②写出上述有关反应的离子方程式:
生成B的离子方程式为。
生成C的离子方程式为。
(2)若A与NaOH无论以何种物质的量比反应,其产物必为B+C,则A的分子式可能是
(只写一种),该反应的离子方程式为。
R在A、B、C中的化合价必须满足的条件是。
氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。
(1)能证明氯水具有漂白性的是__________(填“a”、“b”、“c”或“d”)。
(2)C过程中的现象是__________________________,b过程中的离子方程式为
_____________________________________________________________。
(3)a过程中的化学方程式为________________________________________。