利用如图装置,完成很多电化学实验。下列有关此装置的叙述中,正确的是( )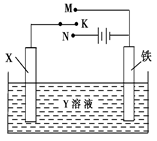
| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法 |
| B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阴离子向铁电极移动 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小 |
设NA为阿伏伽德罗常数的值。下列说法正确的是
| A.室温下,1L pH=1的盐酸中,由水电离的H+离子数目为0. 1NA |
| B.标况下,11.2L SO3所含的分子数目为0.5 NA |
| C.甲烷碱性燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA |
| D.1 mol C2H6O分子中含有的O—H键数目一定为NA |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.明矾溶液:K+、Cl—、HCO3—、OH— |
| B.pH=7的溶液中:Fe3+、Mg2+、NO3—、SO42— |
| C.弱碱性的溶液中:K+、Ca2+、SiO32—、HCO3— |
| D.能使pH试纸变深红色的溶液中:Na+、NH4+、I—、SO42— |
对下图两种化合物的结构或性质描述正确的是
| A.不是同分异构体 |
| B.分子中共平面的碳原子数相同 |
| C.均能与溴水反应 |
| D.可用红外光谱区分,但不能用核磁共振氢谱区分 |
最近科学家成功制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是
| A.该晶体类型是原子晶体 |
| B.该晶体中碳原子和氧原子的个数比为1∶2 |
| C.晶体中碳原子数与C—O化学键数之比为1∶4 |
| D.晶体的空间最小环共有6个原子构成 |
下列说法中正确的是
| A.NO2、SO2、BF3分子中所有原子的最外层电子都满足了8e-稳定结构 |
| B.P4和CH4都是正四面体分子且键角都为109o28ˊ |
| C.NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 |
| D.原子间通过共价键而形成的晶体一定具有高的熔、沸点及硬度 |