工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1mol O2发生反应,则下列说法正确的是 。
A.若反应速率v (SO2) ﹦v (SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
E.平衡后升高温度,平衡常数K增大
F.保持温度和容器体积不变,平衡后再充入2molSO3,再次平衡时各组分浓度均比原平衡时的浓度大
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| SO2 |
O2 |
SO2 |
O2 |
|||
| 1 |
T1 |
4 |
2 |
x |
0.8 |
6 |
| 2 |
T2 |
4 |
2 |
0.4 |
y |
9 |
①实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为 , 表中y ﹦ 。
②T1 T2 ,(选填“>”、“<”或“="”)," 实验2中达平衡时 O2的转化率为 。
(3)尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1 mol/L Na2SO3溶液,实验测定其pH约为8,完成下列问题:
① 该溶液中c(Na+)与 c(OH-)之比为 。
② 该溶液中c(OH-)= c(H+)+ + (用溶液中所含微粒的浓度表示)。
③ 当向该溶液中加入少量NaOH固体时,c(SO32-) , 水的离子积Kw 。(选填“增大”、“减小”或“不变”)
(4)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是 。
A. Na2CO3 B. Ba(NO3)2 C.Na2S D.酸性KMnO4
以下由A→G的合成路线叫做“Krohnke反应”: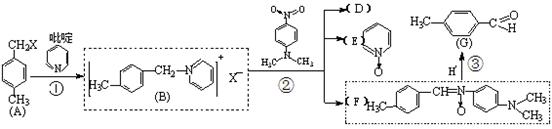
A物质中与苯环相连的“—CH2X”叫做“苄基”。请回答下列问题:
(1)吡啶的分子式为:,用足量的H2还原吡啶,所得的产物的结构简式为
。
(2)A与NaOH水溶液共热,反应方程式为:。
(3)反应②过程: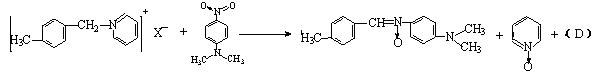
产物中D物质的化学式为;
(4)有关上述过程中的A~G物质,说法正确的是(双选,填序号)
| A.可以用酸性KMnO4溶液区分A和G |
| B.G物质可以命名为3-甲基苯甲醛 |
| C.A→G的合成路线叫做“Krohnke反应在对苄基氧化时保护苯环侧链烃基 |
| D.A和G物质核磁共振氢谱都会产生4种峰 |
(13分)
一定条件下,利胆解痉药“亮菌甲素”跟(CH3)2SO4反应生成A。
二者的结构简式如下图。试回答: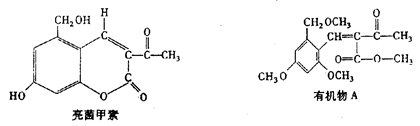
(1)“亮菌甲素”的分子式为_____,1mol“亮菌甲素”跟浓溴水反应时最多消耗____mol Br2;有机物A不能发生的化学反应有_______(填序号)。
①加成反应②酯化反应③水解反应④消去反应
(2)已知: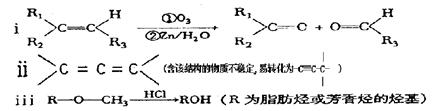
有机物A能发生如下转化: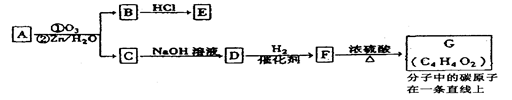
①C→D的化学方程式为____________________________________。
②1mol G跟1mol H2在一定条件下反应,生成物的结构简式为___________。
③符合下列条件E的同分异构体有_____种,写出其中任意一种的结构简式________。
a.遇FeCl3溶液呈紫色; b.不能发生水解反应,但能发生银镜反应;
c.苯环上的一氯取代物只有一种,且分子中无甲基。
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。
(1)①H、C、N、O四种元素的电负性由小到大的顺序为。
②下列叙述不正确的是。(填字母)
A.因为HCHO与水分子间能形成氢键,所以CH2O易溶于水
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个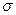 键和1个大
键和1个大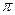 键,C2H2是非极性分子
键,C2H2是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
③氰酸(HOCN) 是一种链状分子,它与异氰酸(HNCO)互为同分异构体
是一种链状分子,它与异氰酸(HNCO)互为同分异构体 ,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式。
,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式。
(2) Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是
②六氰合亚铁离子[Fe(CN)6]4-中不存在__________。
a、共价键 b、非极性键 c、配位键 d、σ键 e、π键
并写出一种与 CN_互为等电子体的单质分子式______________________。
③三氯化铁常温下为固体,熔点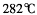 ,沸点
,沸点 ,在
,在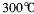 :以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为___________。
:以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为___________。
(3)①Ti的在周期表中位置______________ 。
根据元素原子的外电子排布的特征,可将元素周期表分成五个区域,其中Ti属于区。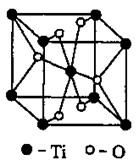
②Ti的一种氧化物X,其晶胞结构如上图所示,则X的化学式为。工业上利用X和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐),制 备M的化学反应方程式是________________________________________;
备M的化学反应方程式是________________________________________;
我国钛铁矿(主要成分为FeTiO3,还含有Al2O3、SiO2等)的储量居世界首位,用钛铁矿制取TiO2和副产品硫酸亚铁晶体的的流程如下: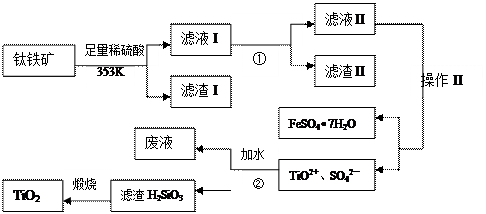
已知:Al(OH)3的Ksp= 1.3ⅹ10-33,Fe(OH)2的Ksp= 1.6ⅹ10-14。
(1)滤液I主要含有TiO2+、SO42—、Fe2+、(填离子符号);
(2)调节PH应最好使用;
| A.Fe | B.Ca(OH)2 | C.NH3•H2O | D.NaOH |
(3)操作II是指洗涤、干燥。
(4)步骤②中发生的化学反应方程式为:;考虑成本和废物综合利用等因素,生产过程中产生的废液中应加入处理较合理。
(5)实验室通常将硫酸亚铁进一步制备为硫酸亚铁铵晶体[(NH4)2Fe(SO4)2•6H2O]以利保存,制备方法被收入中学《实验化学》教材中;专家测定晶体含量的办法是:准确称取m g产品溶解定容至250.00ml,移取25.00ml于锥形瓶中,用c mol·L-1的标准KMnO4溶液滴定至,记录消耗KMnO4溶液的体积为V mL;此时发 生的反应为:
生的反应为:
5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O,(已知硫酸亚铁铵晶体的相对分子质量为3 92),则产品中硫酸亚铁铵晶体纯度的计算式可表达为:w%=。
92),则产品中硫酸亚铁铵晶体纯度的计算式可表达为:w%=。
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。请针对以下三种不同情况回答: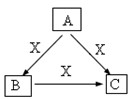
(1)若A、B、C中均含同一种常见金属元素,该元素在 C中以阴离子形式存在,将A、C的水溶液混合可 得B的白色胶状沉淀。
得B的白色胶状沉淀。
① A中含有的金属元素的原子结构示意图为。
②该金属元素的单质与某红色氧化物在高温下反应,可用于焊接铁轨及定向爆破,已知:1mol该单质完全反应,当温度恢复至298K时,共放热QkJ,请写出该反应的热化学反应方程式为。
(2)若A为有机物,75%的A溶液可作为消毒剂,常温常压下B、C均为无色气体,C是一种常见的灭火剂。则A的结构简式为:;利用原电池原理,将B、X分别通入由A制成的两多孔电极,以20%—30%的KOH溶液作为电解质溶液,可以组成化学电源,该电池放电时,负极电极反应式为。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①用化学方程式表明C溶液呈碱性的原因。
②将4.48 L(标准状况下)X通入100 mL3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为___________________。