已知元素A、B、C、D、E、F均属前四周期,且原子序数依次增大, A的p能级电子数是s能级电子数的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能级层均排满,且最外层电子数为1。请回答下列问题:
(1)C原子基态时的电子排布式为 。
(2)B、C两种元素第一电离能为: ﹥ (用元素符号表示)。
试解释其原因: 。
(3)任写一种与AB- 离子互为等电子体的微粒 。
(4)B与C形成的四原子阴离子的立体构型为 ,其中B原子的杂化类型是 。
(5)D和E形成的化合物的晶胞结构如图,其化学式为 ,E的配位数是 ;已知晶体的密度为 ρ g·cm-3,阿伏加德罗常数为NA,则晶胞边长a= cm.(用含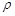 、NA的计算式表示)
、NA的计算式表示)
A、B、C是三种短周期元素,其中A元素原子M层上电子数比L层少2个电子;B元素原子比A元素原子的电子层少,又知B元素最高正价与负化合价的绝对值相等;C 元素的阳离子核外电子排布与Ne原子核外电子排布相同;且又知这三种元素可组成BA2型共价化合物和C2A型离子化合物。由上述条件回答下列问题:
(1)A、B、C三元素的名称分别是:A_______,B_______,C_______。
(2)化合物C2A的电子式是______________,BA2的结构式是:_______________。
(3)A、C的最高价氧化物对应的水化物之间的离子反应方程式为。
随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥。而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2 2NH3
2NH3
(1)在N2+3H2 2NH3的反应中,一段时间后,NH3的浓度增加了0.9 mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9 mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为;
A.2 sB.3 sC.4 sD.6 s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是 ;
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.1 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min-1 D.v(N2)=0.002mol·L-1·min-1
(3)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是。
2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是。
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂3 mol H-H键的同时,断裂6 mol N—H键
D.反应消耗N2、H2与产生NH3的速率之比1︰3︰2
现有①NaCl②金刚石 ③Na ④NaHSO4⑤干冰 ⑥碘片六种物质,按要求回答下列问题(填序号):
(1)属于离子化合物的是,只有离子键的物质是,晶体以分子间作用力结合的是。
(2)NaHSO4熔融状态下电离,破坏了键,写出电离方程式
(3)判断①、②、③、⑤熔沸点高低顺序
将下列物质进行分类(填序号)
①O2与O3 ②126C与136C ③白磷与红磷
④冰与水⑤H2、D2、T2 ⑥乙醇与二甲醚
⑦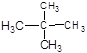 和
和
(1)互为同位素的是(2)互为同素异形体的是
(3)互为同分异构体的是(4)属于同一化合物的是
X、Y、Z、W是中学化学中常见的四种气体。已知:X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收;X是化石燃料燃烧的产物之一,是形成酸雨的物质;Y是一种单质,它的水溶液具有漂白作用;Z是硝酸工业和汽车尾气中的有害物质之一,呈现红棕色,并能与水反应;W气体的水溶液滴入酚酞变红色。
请回答下列问题:
(1)写出各物质的化学式X,Y,Z,W ;
(2)X、Y两种气体按物质的量之比1:1的比例通入品红溶液中,品红,原因(用化学方程式表示);
(3)在Z与水的反应中,氧化剂与还原剂的物质的量之比为。
(4)W和Z在催化剂的作用下可以转化成两种无污染的物质,反应方程式:。