下列关于化学实验的“目的-操作-现象-结论”的描述不正确的是( )
| |
实验目的 |
所加试剂(或操作、图示) |
实验现象 |
实验结论 |
| A |
检验稀盐酸和氢氧化钠溶液是否恰好完全反应 |
在反应后的溶液中滴加无色酚酞试液 |
无明显现象 |
恰好完全反应 |
| B |
判断海水和蒸馏水 |
蒸发结晶 |
液体消失,无残留物 |
该液体为蒸馏水 |
| C |
检验溶液中是否含碳酸根离子或碳酸氢根离子 |
加入稀盐酸再将气体通入石灰水中 |
有无色无味气体产生,且石灰水中有白色浑浊形成 |
溶液中一定含碳酸根离子或碳酸氢根离子 |
| D |
测定空气中氧气的体积分数 |
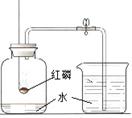 |
完全燃烧后,冷却至室温,打开弹簧夹,进入水的体积约为集气瓶中空气体积的1/5 |
氧气约占空气体积的1/5 |
S8分子形成的单斜硫和斜方硫是同素异形体,转化关系如下:
S(斜方,固) S(单斜,固)△H=+0.398kJ·mol-1若NA为阿伏加德罗常数,则下列说法中,错误的是()
S(单斜,固)△H=+0.398kJ·mol-1若NA为阿伏加德罗常数,则下列说法中,错误的是()
| A.常温下斜方硫比单斜硫稳定 |
| B.单斜硫和斜方硫之间的转化属于物理变化 |
| C.单斜硫和斜方硫在充足的氧气中燃烧均生成SO2 |
| D.64 g 单斜硫和斜方硫的混合物含硫原子数目为2NA |
已知Ksp(AB2)=4.2×10-8,Ksp(AC)=3.0×10-15,在AB2、AC均为饱和的混合液中,测得c(B-)=1.6×10-3 mol·L-1,则溶液中c(C2-)为()
A.1.8×10-13 mol·L-1 B.7.3×10-13 mol·L-1
C.2.3 mol·L-1 D.3.7 mol·L-1
室温下,下列各组离子在指定溶液中能大量共存的是()
| A.饱和氯水中:Cl-、NO3-、Na+、SO32- |
B.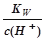 =10-13mol·L-1 溶液中:NH4+、Mg2+、NO3-、SO42- =10-13mol·L-1 溶液中:NH4+、Mg2+、NO3-、SO42- |
| C.通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- |
| D.Na2S溶液中:SO42-、K+、Cl-、Cu2+ |
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A.在0.1mol·L-1NaHCO3溶液中:c(Na+) c(HCO3-) c(HCO3-) c(CO32-) c(CO32-) c(H2CO3) c(H2CO3) |
| B.在0.1mol·L-1Na2CO3溶液中:c(OH-)- c(H+)= c(HCO3-)+2c(H2CO3) |
| C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1mol·L-1NaOH溶液:c(CO32-)> c(HCO3-)> c(OH-)> c(H+) |
| D.常温下,CH3COONa和CH3COOH混合溶液(pH="7," c(Na+)=0.1mol·L-1):c(Na+)= c(CH3COO-)=c(CH3COOH)> c(H+)= c(OH-) |