元素的原子半径在周期表中呈现周期性变化的根本原因是( )。
| A.原子的相对原子质量呈现周期性变化 |
| B.元素的化合价呈现周期性变化 |
| C.原子的性质呈现周期性变化 |
| D.元素原子的核外电子排布呈周期性变化 |
一定条件下进行反应:COCl2(g) Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入
Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入
1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
下列说法正确的是
| A.保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol·L-1,则反应的ΔH<0 |
| B.若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变 |
| C.保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,反应达到平衡前的速率:v(正)<v(逆) |
| D.保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |
25℃时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如右图所示。下列说法正确的是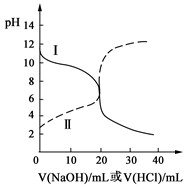
| A.曲线Ⅰ:滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| D.曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
下列实验操作与预期目的或所得结论一致的是
| A.用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,证明该溶液中一定不含有K+ |
| B.向浓度均为0.1 mol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液,产生黄色沉淀,说明Ksp(AgCl)>Ksp(AgI) |
| C.向某溶液中加入硝酸酸化的Ba(NO3)2溶液,出现白色沉淀,说明该溶液一定含有SO42- |
| D.在乙酸、乙醇与乙酸乙酯的混合物中加入适量饱和烧碱溶液充分混合后分液,可得到较纯净的乙酸乙酯 |
CPAE是蜂胶的主要活性成分,由咖啡酸合成CPAE路线如下: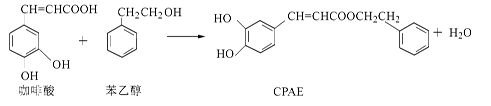
下列说法正确的是
| A.1 mol咖啡酸最多可与含3 mol NaOH的溶液发生反应 |
| B.苯乙醇属于芳香醇,它与邻甲基苯酚互为同系物 |
| C.咖啡酸、苯乙醇及CPAE都能发生取代、加成和消去反应 |
| D.用FeCl3溶液可以检测上述反应中是否有CPAE生成 |
下列说法正确的是
| A.氨水加水稀释后,溶液中c(NH3·H2O) /c(NH4+)的值减小 |
| B.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
| C.常温下,2NO(g)+O2(g)=2NO2(g)能够自发进行,则该反应的△H<0 |
| D.相同条件下,Na2CO3溶液的碱性强于C6H5ONa,说明C6H5OH的酸性强于H2CO3 |