要使金属晶体熔化必须破坏其中的金属键。金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱,而金属键的强弱与金属阳离子所带电荷的多少及半径大小相关。由此判断下列说法正确的是( )。
| A.金属镁的硬度大于金属铝 |
| B.碱金属单质的熔、沸点从Li到Cs是逐渐增大的 |
| C.金属镁的熔点大于金属钠 |
| D.金属镁的硬度小于金属钙 |
X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,其中X与W的质子数之和为21,由此可知
| X |
Y |
||
| Z |
W |
A.Y位于元素周期表中第二周期第VA族
B.Y的氢化物(H2Y)不稳定, 100℃以上即可分解
C.Z的最高价氧化物的水化物既能与强酸反应,也能与强碱反应
D.W的非金属性比Y的非金属性强
某同学用电解原理设计一个观察Fe(OH)2沉淀和Fe(OH)2被氧化的实验装置。如图所示,有关该装置的说法正确的是
| A.断开K2 ,接通K1 ,铁棒和石墨棒上都放出大量气泡,两电极附近溶液颜色均无变化 |
| B.断开K2 ,接通K1 ,仅石墨捧上放出大量气泡,石墨电极附近溶液变红,一段时间后水槽中可见白色沉淀生成且保持较长时间不变色 |
| C.断开K2,接通K1,一段时间后再断开K1,接通K2,由于苯层的保护作用,白色沉淀仍能长时间保持不变色 |
| D.若先断开K1,接通K2,铁棒和石墨棒上都放出大量气泡,石墨电极附近溶液变红 |
下列实验不能达到预期目的的是
| 序号 |
实验操作 |
实验目的 |
| A |
配制FeCl2溶液时,向溶液中加入少量Fe和稀盐酸 |
抑制Fe2+水解和防止Fe2+被氧化 |
| B |
要用蒸馏水润湿pH试纸 |
检验气体的酸碱性 |
| C |
测定等浓度的Na2CO3和Na2SO3 溶液的pH,前者pH比后者的大 |
比较S、C的非金属性强弱 |
| D |
Cu和Al分别为电极,浓硝酸溶液中,构成原电池 |
不能探究Al、Cu的活泼性 |
下列图像表达正确的是
| A.浓硫酸的稀释 |
| B.过量的盐酸与等量的锌粉反应 |
| C.氢气与氧气反应中的能量变化 |
| D.向Mg2+与Al3+的酸性溶液中逐渐加入强碱溶液 |
| X |
Y |
||
| Z |
W |
下列图中的实验方案,能达到实验目的的是
| A |
B |
C |
D |
|
| 实验方案 |
 |
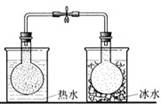 将NO2球浸泡在冰水和热水中 |
 |
 |
| 实验 目的 |
验证FeCl3对H2O2分解反应有催化作用 |
探究温度对平衡 2NO2(g)  N2O4(g)的影响 N2O4(g)的影响 |
除去CO2气体中混有的HCl |
用酒精萃取溴水中的溴 |