小敏对实验室用石灰石和稀盐酸制取二氧化碳后的废液,进行溶质成分鉴定。取废液上层清液50克,逐滴加入质量分数为26.5%的碳酸钠溶液,出现气泡,滴加至10克开始出现白色沉淀。继续滴加至沉淀不再产生,过滤,测得沉淀的质量为5克,并绘制了图像。
1)滴加的溶液中溶质属于 (选填“盐”或“碱”)。
2)10克碳酸钠溶液中含有的溶质质量是 克。
3)图像中的a点数值是 。
4)废液中含有的溶质是 。 (写化学式)。
5)通过计算说明,图像横坐标中的b点表示的溶液的质量是多少克?
向20g CaCO3中不断地加入稀盐酸,其变化图像如图所示,请回答以下问题:
(1)当20g CaCO3完全反应时,所加稀盐酸的质量为g.
(2)求所加稀盐酸的溶质质量分数为多少?
用100g含杂质3.2%的生铁粉(杂质不参与反应),与质量分数为10%的稀硫酸恰好完全反应制硫酸亚铁。求消耗的稀硫酸质量。
某化学兴趣小组欲检验当地石灰石中碳酸钙的纯度。在实验室将25g石灰石样品(杂质不参与反应,也不溶于水)放入盛有100g稀盐酸的烧杯中恰好完全反应。测得烧杯中物质总质量为116.2g。求:
(1)生成二氧化碳的质量。
(2)稀盐酸溶液中溶质的质量分数。
某化学兴趣小组在实验室制取O2时,取KClO3和MnO2的固体混合物若干克,加热至不再产生气体为止。他们通过加水测定剩余固体质量的方法来求出氧气的质量。实验结果如下表:(提示:MnO2是不溶于水的固体粉末)
| 实验序号 |
1 |
2 |
3 |
4 |
| 加水的质量(g) |
15 |
15 |
15 |
15 |
| 剩余固体的质量(g) |
14.1 |
9.3 |
m |
4 |
请回答下列问题:
(1)KClO3的相对分子质量为;
(2)配平化学方程式:2KClO3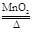 2KCl + O2 ↑;
2KCl + O2 ↑;
(3)表中m值为;
(4)制得氧气的质量是多少?(写出计算过程,3分)
石灰石的主要成分为CaCO3(其余杂质不溶于水,亦不参加反应)。某化学兴趣小组为了测定石灰石中CaCO3的质量分数,进行了以下探究实验:称石灰石样品二份,分别放入大烧杯中,第一个烧杯中加入50克稀盐酸,第二个烧杯中放入100克稀盐酸,充分反应至不再有气泡产生时称量残留物质量,有关数据如下表。求:(1)二个烧杯中CO2的质量;(2)石灰石样品中CaCO3的质量分数;(3)稀盐酸中溶质的质量分数。
| 各物质的质量 |
第一个烧杯 |
第二个烧杯 |
| 样品质量 |
16g |
16 g |
| 稀盐酸质量 |
50g |
100g |
| 烧杯残留物质量 |
61.6 g |
109.4g |
| 产生的CO2质量 |