1 mol丙烷在光照条件下,最多可以与多少摩尔Cl2发生取代反应( )。
| A.4 mol | B.8 mol | C.2 mol | D.6 mol |
下列各组数据中,其比值为2∶1的是( )
A.氨水与(NH4)2SO4溶液混合后pH=7的溶液中,[NH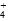 ]∶[SO ]∶[SO ] ] |
| B.相同温度下,0.2 mol·L-1乙酸溶液与0.1 mol·L-1乙酸溶液中,[H+]之比 |
C.Na2CO3溶液中,[Na+]∶[CO ] ] |
| D.pH=12的Ba(OH)2溶液与pH=12的KOH溶液中,c[Ba(OH)2]∶c(KOH) |
Mg(OH)2在水中达到溶解平衡:Mg(OH)2(s) Mg2++2OH-,下列哪种情况可使Mg(OH)2(s)的量减少( )
Mg2++2OH-,下列哪种情况可使Mg(OH)2(s)的量减少( )
| A.加入MgCl2溶液 | B.加入少量NaOH |
| C.加入NH4NO3溶液 | D.加入K2S溶液 |
醋酸溶液中存在电离平衡:CH3COOH H++CH3COO-下列叙述不正确的是( )
H++CH3COO-下列叙述不正确的是( )
| A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| B.0.10 mol·L-1的CH3COOH溶液加水稀释,溶液中c(OH-)减小 |
| C.CH3COOH溶液中加入少量的CH3COONa固体,平衡逆向移动 |
| D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
如图所示用一定浓度的NaOH溶液Y滴定10 mL一定物质的量浓度的盐酸X,依据图示推出X和Y的物质的量浓度是下列各组中的( )
| A |
B |
C |
D |
|
| X物质的量浓度/mol·L-1 |
0.12 |
0.04 |
0.03 |
0.09 |
| Y物质的量浓度/mol·L-1 |
0.04 |
0.12 |
0.09 |
0.03 |
将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为( )
| A.只有AgBr沉淀生成 |
| B.AgCl和AgBr沉淀等量生成 |
| C.AgCl和AgBr沉淀都有,但以AgCl沉淀为主 |
| D.AgCl和AgBr沉淀都有,但以AgBr沉淀为主 |