检验海带中碘元素的实验中,发生如下反应:2H++2I-+H2O2=I2+2H2O,下列对该反应的叙述中不正确的是( )。
| A.I2为氧化产物 |
| B.H2O2既作氧化剂又作还原剂 |
| C.氧化性强弱顺序为H2O2>I2 |
| D.生成1 mol I2时转移2 mol电子 |
下列说法不正确的是
| A.H2S、H2O、HF的热稳定性依次增强 |
| B.NAOH、KOH、Mg(OH)2的碱性依次减弱 |
| C.在过渡元素中寻找优良的催化剂 |
| D.在周期表中金属元素与非金属元素交界处寻找半导体材料 |
A、B两元素可形成AB型化合物,如果A、B两种离子的核外电子数之和为20 ,则A、B两元素所处的周期可能为
A.两种都在在同一周期 B.一种在第一周期,一种在第二周期
C.一种在第二周期,一种在第三周期 D.一种在第三周期,一种在第四周期
下列说法正确的是
| A.稀有气体元素最外层电子数均为8个 |
| B.原子最外层少于4个电子的元素均是金属元素 |
| C.相同条件下,H2O的沸点比H2S高是因为水分子间含有氢键 |
| D.目前人们已发现了5000多种核素,说明发现了5000多种元素 |
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是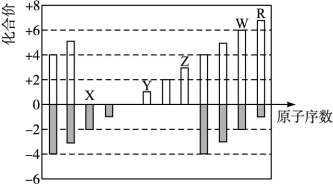
| A.原子半径:Z>Y>X |
| B.气态氢化物的稳定性:R<W |
| C.WX3和水反应形成的化合物是离子化合物 |
| D.Y和Z两者最高价氧化物对应的水化物能相互反应 |
只用一种试剂就能把Na2SO4、NaCl、(NH4)2SO4、NH4Cl四种溶液区分开来,这种试剂是
| A.AgNO3 | B.NaOH | C.BaCl2 | D.Ba(OH)2 |