铁氧体(Fe3O4)法是处理含铬废水的常用方法,其原理是用FeSO4把废水中的Cr2O72-还原为Cr3+,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或FeO·Fe2O3)的复合氧化物(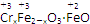 )。处理含1 mol Cr2O72-的废水至少需要加入a mol FeSO4·7H2O,下列结论正确的是( )
)。处理含1 mol Cr2O72-的废水至少需要加入a mol FeSO4·7H2O,下列结论正确的是( )
| A.x=1,a=5 | B.x=0.5,a=8 |
| C.x=1,a=10 | D.x=0.5,a=10 |
为鉴别K2CO3和NaHCO3两种白色固体,有4位同学为鉴别它们,分别设计了下列四种不同的方法,其中不可行的是()
| A.分别逐滴加入1mol/L的盐酸溶液,看产生气泡的先后 |
| B.分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 |
| C.分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀 |
| D.分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色 |
分子式为C6H12O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些醇和酸重新组合可形成的酯共有
| A.16种 | B.9种 | C.25种 | D.144种 |
下列实验中,所采取的分离方法与对应原理都正确的是
| 选项 |
目的 |
分离方法 |
原理 |
| A. |
分离溶于水的碘 |
乙醇萃取 |
碘在乙醇中的溶解度较大 |
| B. |
分离乙酸乙酯和乙醇 |
分液 |
乙酸乙酯和乙醇的密度不同 |
| C. |
除去KNO3固体中混杂的NaCl |
重结晶 |
NaCl在水中的溶解度很大 |
| D. |
除去丁醇中的乙醚 |
蒸馏 |
丁醇与乙醚的沸点相差较大 |
测定某分子式为C11H16的烃结构时,确定其分子中含有2个-CH3、2个-CH2- 和1个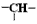 ,且分子中含有苯环。该分子可能的结构有( )
,且分子中含有苯环。该分子可能的结构有( )
| A.2种 | B.3种 | C.4种 | D.5种 |
下列说法中不正确的是( )
| A.红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 |
| B.1mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,一共需要氯气6mol |
| C.苯不能使KMnO4酸性溶液褪色,因此苯不能发生氧化反应 |
| D.维勒用无机物合成了尿素,突破了无机物与有机物的界限 |