a mol FeS与b mol FeO投入V L、c mol·L-1的稀硝酸溶液中充分反应,产生NO气体,
所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)×63 g ②(a+b)×189 g
③(a+b) mol ④(cV-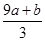 ) mol
) mol
| A.①④ | B.②③ | C.①③ | D.②④ |
以下说法错误的是()
| A |
2Na+2H2O = 2NaOH+H2↑ 2Al+2H2O+2NaOH=2NaAlO2+3H2↑ |
均为水做氧化剂的氧化还原反应 |
| B |
Fe+CuSO4 =FeSO4 +Cu 2Mg+CO2 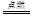 2MgO+C 2MgO+C |
均为固体质量增大的置换反应 |
| C |
NaAlO2+SO2+2H2O =Al(OH)3+NaHSO3 NaClO+CO2+H2O =HClO+NaHCO3 |
均为较强酸制较弱酸的复分解反应 |
| D |
H2O2+SO2 =H2SO4 CaO+SO3 =CaSO4 |
均为非氧化还原反应的化合反应 |
在一定浓度的浓硝酸中加入m克铜镁合金恰好完全溶解(假定硝酸的还原产物只有NO2),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到 v mL时,恰好完全反应,得到沉淀质量为n 克,则下列有关该实验的说法中正确的有( )
①沉淀中氢氧根的质量为(n-m)克 ②恰好溶解后溶液中的NO3-离子的物质的量为bv mol
③反应过程中转移的电子数为 mol ④生成NO2气体的体积为
mol ④生成NO2气体的体积为 L
L
⑤与合金反应反应的硝酸的物质的量为 mol
mol
| A.①②③④⑤ | B.①③④⑤ | C.①③⑤ | D.①②③⑤ |
关于海水综合利用问题,下列说法错误的是()
| A.从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将电能转化为化学能的过程 |
| B.在过程②中若要获得无水MgCl2不可直接蒸干灼烧 |
| C.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 |
| D.第③④步的目的是为了浓缩富集溴 |
下列用数轴表示的产物与量的关系不合理的是()
| A.铁与稀硝酸反应: |
 |
| B.Cl2与FeI2溶液反应后的产物: |
 |
| C.向烧碱液中通入SO2后的产物: |
 |
| 向AlCl3溶液中滴加NaOH溶液,铝元素的存在形式: |
 |
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是()
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
SO2和氯水有漂白性 |
两者都能使溴水褪色 |
| B |
C的还原性比Si强 |
C与SiO2反应得到硅单质 |
| C |
盐酸和氨水能溶解Al(OH)3 |
Al(OH)3是两性氢氧化物 |
| D |
CuSO4可以使蛋白质变性 |
误食铜盐使人中毒 |